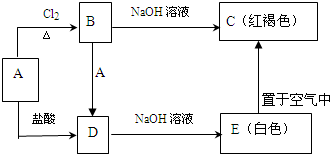
题目内容
运用元素周期律分析下面的推断正确的是( )
| A、硒化氢是无色、有毒、比硫化氢稳定的气体 |
| B、砹单质是一种有色固体,砹化氢很不稳定,砹化银是难溶于水的白色沉淀 |
| C、硫酸锶难溶于水,但易溶于盐酸 |
| D、铍(Be)是一种轻金属,它的氧化物的水化物可能具有两性 |
考点:元素周期律和元素周期表的综合应用,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A.S非金属性比Se的强;
B.非金属性越弱,气态氢化物越不稳定,AgI为黄色固体,结合递变规律分析;
C.硫酸钡不溶于水和盐酸,结合结合递变规律分析;
D.Be与Al位于对角线位置,性质相似.
B.非金属性越弱,气态氢化物越不稳定,AgI为黄色固体,结合递变规律分析;
C.硫酸钡不溶于水和盐酸,结合结合递变规律分析;
D.Be与Al位于对角线位置,性质相似.
解答:
解:A.S非金属性比Se的强,则硒化氢是无色、有毒、不如硫化氢稳定的气体,故A错误;
B.非金属性越弱,气态氢化物越不稳定,AgI为黄色固体,则砹单质是一种有色固体,砹化氢很不稳定,砹化银是难溶于水的有色沉淀,故B错误;
C.Ba、Sr同主族,硫酸钡不溶于水和盐酸,则硫酸锶难溶于水,不溶于盐酸,故C错误;
D.Be与Al位于对角线位置,性质相似,由氢氧化铝具有两性可知,铍(Be)是一种轻金属,它的氧化物的水化物可能具有两性,故D正确;
故选D.
B.非金属性越弱,气态氢化物越不稳定,AgI为黄色固体,则砹单质是一种有色固体,砹化氢很不稳定,砹化银是难溶于水的有色沉淀,故B错误;
C.Ba、Sr同主族,硫酸钡不溶于水和盐酸,则硫酸锶难溶于水,不溶于盐酸,故C错误;
D.Be与Al位于对角线位置,性质相似,由氢氧化铝具有两性可知,铍(Be)是一种轻金属,它的氧化物的水化物可能具有两性,故D正确;
故选D.
点评:本题考查元素周期表和周期律的综合应用,为高频考点,把握元素的位置、性质及元素周期律的应用为解答的关键,侧重分析与应用能力的考查,注意递变规律及对角线规则,题目难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
存放下列试剂的方法中,有错误并且会引起危险的是( )
| A、白磷浸在盛有CS2的敞口试剂瓶中 |
| B、金属钠浸在盛有煤油的试剂瓶中 |
| C、浓硝酸存放在棕色试剂瓶中 |
| D、溴水放在带玻璃塞的试剂瓶中 |
已知图一表示的是可逆反应CO(g)+H2(g)?C(s)+H2O(g)△H>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)?N2O4(g)△H<0的浓度(c)随时间(t)的变化情况.下列说法中正确的是( )
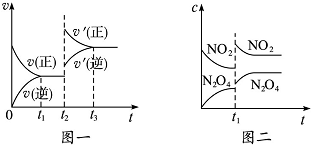

| A、图一t2时改变的条件可能是升高了温度或增大了压强 |
| B、图一t2时改变的条件一定是增大了反应物的浓度 |
| C、图二t1时改变的条件可能是升高了温度或增大了压强 |
| D、若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
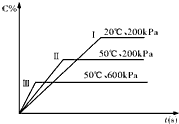 在密闭容器中进行以下可逆反应:A(g)+B(g)?C(g)+2D(?),在不同的条件下C的百分含量的变化情况如如图,则该反应描述正确的是( )
在密闭容器中进行以下可逆反应:A(g)+B(g)?C(g)+2D(?),在不同的条件下C的百分含量的变化情况如如图,则该反应描述正确的是( )| A、正反应放热,D是固体 |
| B、正反应放热,D是气体 |
| C、正反应吸热,D是气体 |
| D、正反应放热,D是固体或气体 |
将5.6g铁粉放入一定量某浓度的硝酸溶液中,待铁粉全部溶解后,共收集到NO、NO2(其他气体忽略不计)混合气体0.15mol,该混合气体中NO与NO2的体积比可能是( )
| A、1:2 | B、2:1 |
| C、3:2 | D、3:1 |
下列溶液中Cl-的物质的量浓度最大的是( )
| A、300 mL 3.5 mol/L KCl溶液 |
| B、1 000 mL 2.5 mol/L NaCl溶液 |
| C、250 mL 1 mol/L AlCl3溶液 |
| D、200 mL 2 mol/L MgCl2溶液 |