题目内容
在2L密闭容器中加入或通入一定量A、B、C三种物质,在一定条件下发生反应(如图1),3min后给体系加热,气体C的体积分数Ψ(C)和混合气体的平均相对分子质量M均随温度分别发生了图示变化(如图2、图3).下列有关说法不正确的是( )
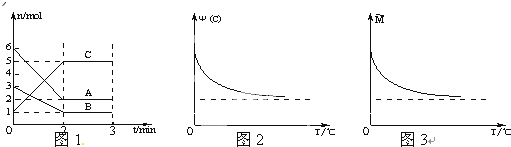

| A、前2min中C的平均反应速率为1mol/L?min |
| B、该反应的化学方程式为:2A+B?2C |
| C、正反应是放热反应 |
| D、A、B一定均为气态 |
考点:化学平衡建立的过程
专题:化学平衡专题
分析:A、根据v=
计算;
B、根据反应物质和生成物的物质的量变化量之比等于计量数比求算;
C、加热后,气体C的体积分数Ψ(C)减小,平衡左移;
D、根据混合气体的平均相对分子质量M=
计算,
| △c |
| △t |
B、根据反应物质和生成物的物质的量变化量之比等于计量数比求算;
C、加热后,气体C的体积分数Ψ(C)减小,平衡左移;
D、根据混合气体的平均相对分子质量M=
| m(气体) |
| V |
解答:
解:A、根据v=
=
=1mol/(L?min),故A正确;
B、A的浓度较小为反应物,A的物质的量减小量为4mol,B的物质的量的减小量为2mol,C的物质的量增大量为4mol,则A、B、C的计量数之比为2:1:2,所以反应方程式为:2A+B?2C,故B正确;
C、加热后,气体C的体积分数Ψ(C)减小,说明平衡左移,正反应为放热反应,故C正确;
D、根据混合气体的平均相对分子质量M=
减小,若A、B一定均为气态,则气体总质量不变,容器的体积不变,则M=
不变,和图象不符,故D错误.
故选:D.
| △c |
| △t |
| ||
| 2min |
B、A的浓度较小为反应物,A的物质的量减小量为4mol,B的物质的量的减小量为2mol,C的物质的量增大量为4mol,则A、B、C的计量数之比为2:1:2,所以反应方程式为:2A+B?2C,故B正确;
C、加热后,气体C的体积分数Ψ(C)减小,说明平衡左移,正反应为放热反应,故C正确;
D、根据混合气体的平均相对分子质量M=
| m(气体) |
| V |
| m(气体) |
| V |
故选:D.
点评:本题考查了反应速率的计算、反应方程式的确定等,题目涉及的内容较多,侧重于考查学生对所学知识的综合应用能力,题目难度中等.

练习册系列答案
相关题目
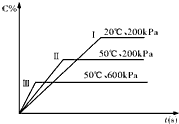 在密闭容器中进行以下可逆反应:A(g)+B(g)?C(g)+2D(?),在不同的条件下C的百分含量的变化情况如如图,则该反应描述正确的是( )
在密闭容器中进行以下可逆反应:A(g)+B(g)?C(g)+2D(?),在不同的条件下C的百分含量的变化情况如如图,则该反应描述正确的是( )| A、正反应放热,D是固体 |
| B、正反应放热,D是气体 |
| C、正反应吸热,D是气体 |
| D、正反应放热,D是固体或气体 |
将5.6g铁粉放入一定量某浓度的硝酸溶液中,待铁粉全部溶解后,共收集到NO、NO2(其他气体忽略不计)混合气体0.15mol,该混合气体中NO与NO2的体积比可能是( )
| A、1:2 | B、2:1 |
| C、3:2 | D、3:1 |
下列微粒不具有氧化性的是( )
| A、Cl2 |
| B、Cl- |
| C、H+ |
| D、Fe2+ |
下列说法正确的是( )
| A、Na2O2、Cl2、SO2依次属于电解质、单质、非电解质 |
| B、标准状况下,1 mol Na2O2和22.4 L SO2反应,转移电子数目为NA |
| C、等物质的量Cl2和SO2同时通入品红溶液,褪色更快 |
| D、在Na2O2中阴阳离子所含的电子数目相等 |
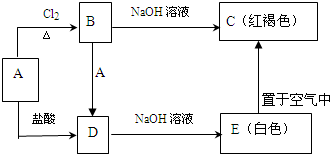
 某实验小组在研究“反应条件对化学平衡的影响”时做了如下3个实验.
某实验小组在研究“反应条件对化学平衡的影响”时做了如下3个实验.