题目内容
9.25℃时,水的电离达到平衡:H2O?H++OH-,下列叙述正确的是( )| A. | 将水加热,Kw增大,pH不变 | |
| B. | 向水中加入少量盐酸,c(H+)增大,Kw不变 | |
| C. | 向水中加入NaOH固体,平衡逆向移动,c(OH-)降低 | |
| D. | 向水中加入AlCl3固体,平衡正向移动,c(OH-)增大 |
分析 水的电离平衡:H2O?H++OH-中,要使平衡发生移动,应改变溶液c(H+)或c(OH-)的浓度,水的电离是吸热过程,升高温度,平衡向电离方向移动,K增大,c(H+),则pH减小.
解答 解:A.水的电离是吸热过程,升高温度,平衡向电离方向移动,K增大,c(H+),则pH减小,故A错误;
B.向水中加入少量盐酸,抑制水的电离,c(H+)增大,平衡逆向进行,温度不变Kw不变,故B正确;
C.向水中加入少量固体NaOH,c(OH-)增大,平衡逆向移动,c(H+)降低,故C错误;
D.向水中加入AlCl3固体,溶解后铝离子水解促进水的电离,平衡正向移动,c(OH-)浓度减小,c(H+)浓度增大,故D错误;
故选B.
点评 本题考查水的电离平衡移动,题目难度不大,注意从浓度、温度对平衡移动的影响角度分析,本题易错点为A,注意升高温度c(H+),pH减小.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
10.下列装置能实现实验目的是( )
| A. | 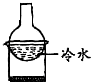 加热烧杯,除去NH4Cl中混有的I2 | B. | 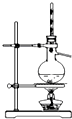 分离溴苯与苯的混合物 | ||
| C. | 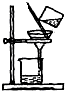 分离淀粉与葡萄糖的混合液 | D. | 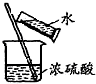 稀释浓硫酸 |
11.已知向KI溶液中通入过量Cl2时,生成的I2可进一步氧化成IO3-,若通入Cl2的物质的量为amol,溶液中KI的物质的量为bmol(不考虑单质与水的反应),下列说法不正确的是( )
| A. | I2与Cl2反应的离子方程式为:I2+5Cl2+6H2O=2IO3-+12H++10Cl- | |
| B. | 当a=3b时,发生反应的离子方程式为:I-+3Cl2+3H2O=IO3-+6Cl-+6H+ | |
| C. | 当a=2b时,发生反应的离子方程式为:5I-+10Cl2+9H2O=3IO3-+20Cl-+I2+18H+ | |
| D. | 若反应后溶液中I2与IO3-的物质的量之比为1:1,则反应中转移电子3.5bmol |
17.下列做法不符合绿色化学原则的是( )
| A. | 提高能源的利用率 | B. | 应用无毒无害的催化剂 | ||
| C. | 使用可以再生的资源 | D. | 工业及生活废水的任意排放 |
4.配制FeCl3溶液时,为防止出现浑浊,可向该溶液中加入少量( )
| A. | 铁 | B. | 盐酸 | C. | 氯化钠 | D. | 氢氧化钠 |
1.Na和Na+两种粒子中,不相同的是( )
①核内质子数;②核外电子数;③最外层电子数;④核外电子层数.
①核内质子数;②核外电子数;③最外层电子数;④核外电子层数.
| A. | ①② | B. | ②③ | C. | ②③④ | D. | ①③ |
18.氧族元素的氢化物的沸点如表:
下列关于氧族元素氢化物的沸点高低的分析和推断中,正确的是( )
| H2O | H2S | H2Se | H2Te |
| 100℃ | -60.75℃ | -41.5℃ | -1.8℃ |
| A. | 氧族元素氢化物沸点高低与范德华力的大小无关 | |
| B. | 范德华力一定随相对分子质量的增大而减小 | |
| C. | 水分子间可能还存在一种特殊的分子间作用力 | |
| D. | 水分子间存在共价键,加热时较难断裂 |
19.在一定条件下,完全分解下列某化合物2g,产生氧气1.8g,此化合物是( )
| A. | 1H216O | B. | 1H218O | C. | 2H216O | D. | 2H218O |