题目内容
1.下表是元素周期表的一部分.主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)在⑦、⑧、⑨、⑩4种元素中,原子半径最大的是Mg(填元素符号),其原子结构示意图为
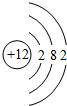 .
.(3)写出⑤元素的最高价氧化物的水化物与其气态氢化物发生反应的化学方程式:NH3+HNO3═NH4NO3.
(4)写出元素⑦的氯化物的水溶液与NaOH溶液反应的离子方程式:Mg2++2OH-═Mg(OH)2↓.
(5)要证明⑥元素比⑨元素的氧化性强的化学方程式为:2H2S+O2═2H2O+2S↓.
分析 由元素在周期表的位置可知,①~⑩分别为H、Li、Be、B、N、O、Mg、Al、S、Cl,
(1)元素⑩的氢化物为HCl,非金属性越强,对应氢化物的还原性越弱;
(2)同周期从左向右原子半径减小;
(3)⑤元素的最高价氧化物的水化物与其气态氢化物发生反应,生成硝酸铵;
(4)氯化镁与NaOH反应生成氢氧化镁沉淀和氯化钠;
(5)单质之间的置换反应可说明⑥元素比⑨元素的氧化性强.
解答 解:由元素在周期表的位置可知,①~⑩分别为H、Li、Be、B、N、O、Mg、Al、S、Cl,
(1)元素⑩的氢化物为HCl,非金属性越强,对应氢化物的还原性越弱,则HCl的还原性比元素⑨的氢化物的还原性弱,
故答案为:HCl;弱;
(2)同周期从左向右原子半径减小,则在⑦、⑧、⑨、⑩4种元素中,原子半径最大的是Mg,原子结构示意图为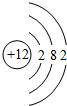 ,
,
故答案为:Mg;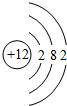 ;
;
(3)⑤元素的最高价氧化物的水化物与其气态氢化物发生反应,生成硝酸铵,反应为NH3+HNO3═NH4NO3,故答案为:NH3+HNO3═NH4NO3;
(4)元素⑦的氯化物的水溶液与NaOH溶液反应的离子方程式为Mg2++2OH-═Mg(OH)2↓,故答案为:Mg2++2OH-═Mg(OH)2↓;
(5)⑥元素比⑨元素的氧化性强的化学方程式如2H2S+O2═2H2O+2S↓(或2H2SO3+O2═2H2SO4,2Na2SO3+O2═2Na2SO4,2SO2+O2═2SO3,2Na2S+O2+2H2O═2S↓+4NaOH等),故答案为:2H2S+O2═2H2O+2S↓.
点评 本题考查位置、结构与性质的关系,为高频考点,把握素的位置和性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
相关题目
12.化学在保证人类的生存并不断提高人类的生活质量方面起着重要作用,它与科学、技术、社会、环境密切相关.下列有关化学与社会的说法中正确的是( )
| A. | 淀粉、纤维素及橡胶制品都是天然高分子材料 | |
| B. | 向牛奶中加人果汁会产生沉淀,这是因为酸碱发生了中和反应 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 |
16.五千多年前,人类就开始了对铁的使用.下列有关铁的说法中正确的是( )
| A. | 工业上通常把金属分为黑色金属和有色金属,铁属于黑色金属,是因为铁是黑色的 | |
| B. | 常温下,铁制容器可以用来贮存浓硫酸 | |
| C. | 铁的最高价是+3价,是因为铁原子的最外层有3个电子 | |
| D. | 在地壳中铁大多以游离态存在 |
13.下列物质的变化,不能通过一步化学反应完成的是( )
| A. | Al2O3→NaAlO2 | B. | Cl2→HClO | C. | Al2O3→Al(OH)3 | D. | H2SO4(浓)→SO2 |
10.下列装置能实现实验目的是( )
| A. | 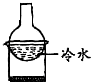 加热烧杯,除去NH4Cl中混有的I2 | B. | 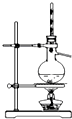 分离溴苯与苯的混合物 | ||
| C. | 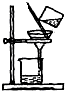 分离淀粉与葡萄糖的混合液 | D. | 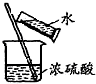 稀释浓硫酸 |
11.已知向KI溶液中通入过量Cl2时,生成的I2可进一步氧化成IO3-,若通入Cl2的物质的量为amol,溶液中KI的物质的量为bmol(不考虑单质与水的反应),下列说法不正确的是( )
| A. | I2与Cl2反应的离子方程式为:I2+5Cl2+6H2O=2IO3-+12H++10Cl- | |
| B. | 当a=3b时,发生反应的离子方程式为:I-+3Cl2+3H2O=IO3-+6Cl-+6H+ | |
| C. | 当a=2b时,发生反应的离子方程式为:5I-+10Cl2+9H2O=3IO3-+20Cl-+I2+18H+ | |
| D. | 若反应后溶液中I2与IO3-的物质的量之比为1:1,则反应中转移电子3.5bmol |

 ,丁二烯(电子式)
,丁二烯(电子式) .
. 是由三种单体通过加聚反应而制得的.这三种单体的结构简式是CH2=C(CH3)-CH=CH2、CH3-CH=CH2、CH2=CH2.
是由三种单体通过加聚反应而制得的.这三种单体的结构简式是CH2=C(CH3)-CH=CH2、CH3-CH=CH2、CH2=CH2.