题目内容
15.FeCl3的水溶液显酸性,用离子方程式解释Fe3++3H2O?Fe(OH)3+3H+.分析 FeCl3为强酸弱碱盐,铁离子水解而使其溶液呈酸性,水解离子反应方程式为Fe3++3H2O?Fe(OH)3+3H+,由此分析解答.
解答 解:FeCl3为强酸弱碱盐,铁离子水解而使其溶液呈酸性,水解离子反应方程式为Fe3++3H2O?Fe(OH)3+3H+,故答案为:Fe3++3H2O?Fe(OH)3+3H+.
点评 本题考查了盐类水解,根据“谁强谁显性、谁弱谁水解”的规律来分析氯化铁溶液酸碱性,再结合盐类水解的影响因素来分析解答,题目难度不大.

练习册系列答案
相关题目
5.下列判断正确的是( )
| A. | 酸酐一定是氧化物 | |
| B. | 酸性氧化物一定是非金属氧化物 | |
| C. | 碱性氧化物一定是金属氧化物 | |
| D. | 正四面体分子中键角一定是109°28′ |
6.一定温度下,在固定容积的密闭容器中发生反应:2HI═H2+I2,若c(HI)由0.1mol/L降到0.07mol/L需要15s,那么c(HI)由0.07mol/L降到0.06mol/L所需的反应时间为( )
| A. | 等于5 s | B. | 大于5 s | C. | 等于10 s | D. | 小于5 s |
3.下列有关碱金属元素的说法正确的是( )
| A. | 锂与过量氧气反应,生成过氧化锂 | B. | 从锂到铯,密度由小到大 | ||
| C. | 从锂到铯,熔沸点依次升高 | D. | 钠与水反应不如钾与水反应剧烈 |
10.NA代表阿伏加德罗常数,下列说法中正确的是( )
| A. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| B. | 1L0.1 mol/L的NH4NO3溶液中氮原子数小于0.2NA | |
| C. | 某温度时,1LpH=6的纯水中含有1.0X10-6NA个OH- | |
| D. | 含0.1 mol FeCl3的溶液完全水解后得到的胶体粒子个数为0.1 NA |
4.以下物质间的转化不能通过一步反应就能实现的是( )
| A. | Fe(OH)3→Fe2O3→Fe | B. | NH3→NO→NO2→HNO3 | C. | S→SO3→H2SO4 | D. | Cl2→HClO→NaClO |
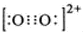 ;1mol O22+中含有的π键数目为2NA.
;1mol O22+中含有的π键数目为2NA.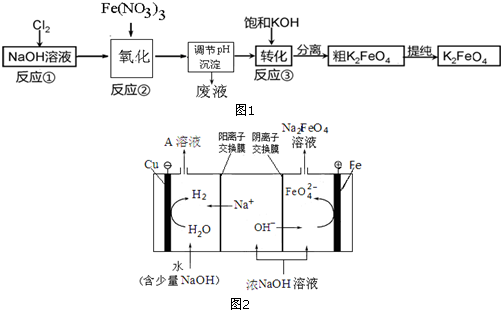
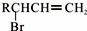 .
.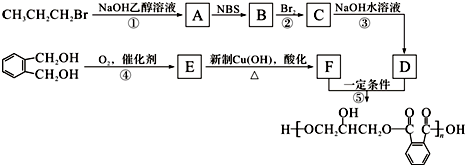
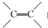 ,C的名称是1,2,3-三溴丙烷.
,C的名称是1,2,3-三溴丙烷.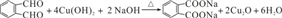 ;
;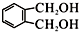 的同分异构体中同时符合下列条件的芳香族化合物共有6种.
的同分异构体中同时符合下列条件的芳香族化合物共有6种.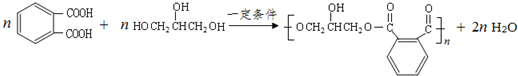 .
.