题目内容
3.关于一定条件下进行的反应CH4+2NO2=N2+CO2+2H2O,下列说法正确的是( )| A. | CH4、N2、CO2均属于非电解质 | B. | NO2、CO2、H2O均属于氧化物 | ||
| C. | CH4、NO2、CO2均属于非极性分子 | D. | 该反应属于置换反应 |
分析 A.水溶液中和熔融状态下都不导电的化合物为非电解质;
B.两种元素组成其中一种为氧元素的化合物为氧化物;
C.非极性分子有两类,一是非金属单质,二是结构对称的分子,分子中正负电荷重心重叠;
D.一种单质和一种化合物反应生成另一种单质和另一种化合物的反应为置换反应;
解答 解:A.CH4、CO2均不能电离出离子,属于非电解质,N2为单质不是电解质和非电解质,故A错误;
B.NO2、CO2、H2O符合氧化物概念均属于氧化物,故B正确;
C.CH4、CO2均属于非极性分子,NO2分子结构不对称属于极性分子,故C错误;
D.CH4+2NO2=N2+CO2+2H2O反应不符合置换反应的概念,故D错误;
故选B.
点评 本题考查了物质分类、反应类型、分子极性等知识点的分析判断,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
14.化工生产需要用到各种原料,其中与事实相符合的是( )
| A. | 用乙醇和浓硫酸制乙烯 | B. | 用电解水获得的氢气来合成氨 | ||
| C. | 用晒盐后的卤水制溴单质 | D. | 用氢氧化钠和二氧化碳制碳酸钠 |
11.用NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )
| A. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA | |
| B. | 11.2mol•L-1K2S溶液中S2-和HS-的总数为2NA | |
| C. | 300ml2mol•L-1蔗糖溶液中所含分子数为0.6NA | |
| D. | 标准状况下,30g乙酸和甲醛的混合物中氧原子数为NA |
18.化学与生产、生活、环境等社会实际密切相关.下列叙述正确的是( )
| A. | “滴水石穿、绳锯木断”不涉及化学变化 | |
| B. | 明矾净水的原理和“84”消毒液消毒的原理不相同 | |
| C. | 氟利昂作制冷剂会加剧雾霾天气的形成 | |
| D. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 |
8.亚硝酸钠是重要的防腐剂,某化学兴趣小组制备亚硝酸钠并测定其纯度.
【查阅资料】①NO与Na2O2反应为:2NO+Na2O2=2NaNO2;NO与碱不反应,能被酸性KMnO4溶液氧化为硝酸. ②NO2与Na2O2反应为:2NO2+Na2O2=2NaNO3.
【实验探究一】制备亚硝酸钠
以碳和浓硝酸为起始原料,设计如下装置制备亚硝酸钠(部分夹持装置和A中的加热装置已略去).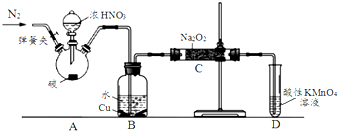
(1)装置A中烧瓶内发生反应的化学方程式是C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,装置B中的现象是B中溶液由无色变为蓝色,铜片表面有气泡产生.
(2)在加热装置A前应打开弹簧夹通一会N2,目的是排尽装置中的空气,防止C中产生NaNO3.
(3)装置C中的产物除NaNO2外,还可能有Na2CO3NaOHNaNO3(填化学式),为排除干扰,应在装置B、C间增加装置E,E中盛放的试剂应是B(填字母).
A.浓H2SO4 B.碱石灰 C.无水CaCl2 D.NaOH溶液
【实验探究二】测定亚硝酸钠的含量
称取装置C中反应后的固体4.000g溶于水,配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
(4)第一组实验数据出现异常,造成这种异常的原因可能是AC(填字母).
A.酸式滴定管未用标准液润洗 B.锥形瓶洗净后未干燥 C.滴定终了仰视读数
(5)根据表中数据,计算所得固体中亚硝酸钠的质量分数是86.25%或0.8625.
【查阅资料】①NO与Na2O2反应为:2NO+Na2O2=2NaNO2;NO与碱不反应,能被酸性KMnO4溶液氧化为硝酸. ②NO2与Na2O2反应为:2NO2+Na2O2=2NaNO3.
【实验探究一】制备亚硝酸钠
以碳和浓硝酸为起始原料,设计如下装置制备亚硝酸钠(部分夹持装置和A中的加热装置已略去).

(1)装置A中烧瓶内发生反应的化学方程式是C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,装置B中的现象是B中溶液由无色变为蓝色,铜片表面有气泡产生.
(2)在加热装置A前应打开弹簧夹通一会N2,目的是排尽装置中的空气,防止C中产生NaNO3.
(3)装置C中的产物除NaNO2外,还可能有Na2CO3NaOHNaNO3(填化学式),为排除干扰,应在装置B、C间增加装置E,E中盛放的试剂应是B(填字母).
A.浓H2SO4 B.碱石灰 C.无水CaCl2 D.NaOH溶液
【实验探究二】测定亚硝酸钠的含量
称取装置C中反应后的固体4.000g溶于水,配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
A.酸式滴定管未用标准液润洗 B.锥形瓶洗净后未干燥 C.滴定终了仰视读数
(5)根据表中数据,计算所得固体中亚硝酸钠的质量分数是86.25%或0.8625.
15.在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq)$\stackrel{NaOH(aq)}{→}$Fe(OH)2 | |
| B. | Al3+$\stackrel{过量氨水}{→}$Al${\;}_{2}^{-}$$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| C. | NH3$\stackrel{O_{2}}{→}$NO$\stackrel{H_{2}O}{→}$HNO3 | |
| D. | 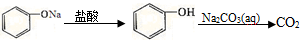 |
 .
.