题目内容
12.氢气、甲烷完全燃烧的热化学方程式如下:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
将氢气、甲烷按一定比例混合,所得气体的密度是相同条件下N2的$\frac{1}{2}$,则9.8g该混合物完全燃烧能放出的热量最多为( )
| A. | 280.58kJ | B. | 562.76kJ | C. | 530.58kJ | D. | 890.3kJ |
分析 设氢气的质量为x,物质的量为$\frac{x}{2}$mol,则甲烷的质量为9.8g-x,物质的量为$\frac{9.8g-x}{16}$mol,混合气体的摩尔质量为$\frac{9.8g}{\frac{x}{2}mol+\frac{9.8g-x}{16}}$,根据相同条件下,气体的摩尔质量之比等于密度之比求出质量,然后根据热化学方程式求出反应放出的热量.
解答 解:设氢气的质量为x,物质的量为$\frac{x}{2}$mol,则甲烷的质量为9.8g-x,
物质的量为$\frac{9.8g-x}{16}$mol,混合气体的摩尔质量为$\frac{9.8g}{\frac{x}{2}mol+\frac{9.8g-x}{16}}$,
气体密度是相同条件下氮气密度的一半,即$\frac{9.8g}{\frac{x}{2}mol+\frac{9.8g-x}{16}}$=14,
解得:x=0.2g,则氢气、甲烷的质量分别为0.2g,9.6g,物质的量为0.1mol,0.6mol,
由氢气、甲烷的热化学方程式:2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ•mol-1;CH4(g)+2O2(g)═CO2(g)+2H2O可知0.1mol氢气燃烧放出的热量$\frac{571.6kJ}{2}$×0.1=28.58kJ,0.6mol甲烷燃烧放出的热量为890.3kJ×0.6=534.18kJ,
共放出热量为28.58kJ+534.18kJ=562.76kJ,
故选B.
点评 本题考查了反应中热量的计算、侧重于对基础知识综合应用的考查,题目难度中等.

练习册系列答案
相关题目
3.关于一定条件下进行的反应CH4+2NO2=N2+CO2+2H2O,下列说法正确的是( )
| A. | CH4、N2、CO2均属于非电解质 | B. | NO2、CO2、H2O均属于氧化物 | ||
| C. | CH4、NO2、CO2均属于非极性分子 | D. | 该反应属于置换反应 |
20.25℃时,0.1mol Na2CO3与稀盐酸混合所得的体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )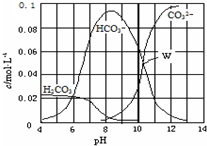

| A. | W点所示的溶液:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) | |
| B. | pH=4的溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1 mol•L-1 | |
| C. | 向pH=8的溶液中通入CO2至pH=7所得的溶液:c(Na+)>c(Cl-)+c(HCO3-)+c(H2CO3) | |
| D. | pH=11的溶液:c(Na+)+2c(H2CO3)>2c(Cl-)+2c(CO32-) |
7.为验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
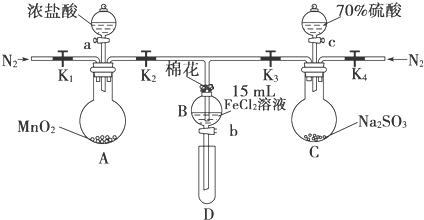
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,关闭K2.
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子.
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰.
(2)检验B中溶液是否还有Fe2+的方法之一是:取少量B中溶液于试管中,滴加几滴含有+3价铁元素的配合物溶液,会产生蓝色沉淀,写出该反应的离子方程式3Fe2++2(Fe(CN)6)3-=Fe3(Fe(CN)6)2↓.
(3)若向第III步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式2Fe3++H2S═2Fe2++2H++S↓.
(4)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的化学方程式为2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4.
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示.他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是乙、丙(填“甲”、“乙”或“丙”).
(6)将B中的FeCl2溶液换成100mLFeBr2溶液并向其中通入1.12LCl2(标准状况下),若溶液中有$\frac{1}{2}$的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为0.5mol/L.

实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,关闭K2.
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子.
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程Ⅰ的目的是排出装置中的空气,防止干扰.
(2)检验B中溶液是否还有Fe2+的方法之一是:取少量B中溶液于试管中,滴加几滴含有+3价铁元素的配合物溶液,会产生蓝色沉淀,写出该反应的离子方程式3Fe2++2(Fe(CN)6)3-=Fe3(Fe(CN)6)2↓.
(3)若向第III步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式2Fe3++H2S═2Fe2++2H++S↓.
(4)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的化学方程式为2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4.
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示.他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是乙、丙(填“甲”、“乙”或“丙”).
| 过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
4.下列溶液中各微粒的浓度关系正确的是( )
| A. | 0.2 mol/L的CH3COOH溶液与0.1 mol/L CH3COOH溶液中c(H+)之比为2:1 | |
| B. | 0.1 mol/L NaHCO3溶液中,c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 0.1 mol/L 的NaHA溶液,其pH=4,则c(HA-)>c(A2-)>c(H2A) | |
| D. | 只含Na+、CH3COO-、H+、OH-的酸性溶液中,c(H+)>c(CH3COO-)>c(Na+)>c(OH-) |
1.常温下,pH=11的氨水和pH=1的盐酸等体积混合后(混合溶液体积为两溶液体积之和),恰好完全反应,则下列说法错误的是( )
| A. | 弱碱的浓度大于强酸的浓度 | |
| B. | 原氨水中有1%的含氮微粒为NH4+ | |
| C. | 反应后的溶液呈酸性 | |
| D. | 混合溶液中c(NH4+)+c(NH3•H2O)+c(NH3)=5×10-4mol/L |
 图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水.向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝.
图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水.向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝.