题目内容
8.亚硝酸钠是重要的防腐剂,某化学兴趣小组制备亚硝酸钠并测定其纯度.【查阅资料】①NO与Na2O2反应为:2NO+Na2O2=2NaNO2;NO与碱不反应,能被酸性KMnO4溶液氧化为硝酸. ②NO2与Na2O2反应为:2NO2+Na2O2=2NaNO3.
【实验探究一】制备亚硝酸钠
以碳和浓硝酸为起始原料,设计如下装置制备亚硝酸钠(部分夹持装置和A中的加热装置已略去).
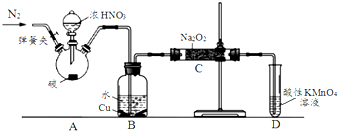
(1)装置A中烧瓶内发生反应的化学方程式是C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,装置B中的现象是B中溶液由无色变为蓝色,铜片表面有气泡产生.
(2)在加热装置A前应打开弹簧夹通一会N2,目的是排尽装置中的空气,防止C中产生NaNO3.
(3)装置C中的产物除NaNO2外,还可能有Na2CO3NaOHNaNO3(填化学式),为排除干扰,应在装置B、C间增加装置E,E中盛放的试剂应是B(填字母).
A.浓H2SO4 B.碱石灰 C.无水CaCl2 D.NaOH溶液
【实验探究二】测定亚硝酸钠的含量
称取装置C中反应后的固体4.000g溶于水,配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
A.酸式滴定管未用标准液润洗 B.锥形瓶洗净后未干燥 C.滴定终了仰视读数
(5)根据表中数据,计算所得固体中亚硝酸钠的质量分数是86.25%或0.8625.
分析 (1)装置A烧瓶中,碳和浓硝酸反应生成二氧化碳、二氧化氮和水,装置B中二氧化氮通入和水反应生成硝酸,硝酸具有强氧化性能氧化铜生成硝酸铜溶液同时生成一氧化氮气体;
(2)为避免装置中的空气导致产品不纯,需要打开弹簧夹通入氮气排净装置中的空气;
(3)有同学认为装置c中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,那么NO中混有CO2、NO2,可以在B、C之间增加装有碱石灰或生石灰的装置E,以吸收杂质CO2、NO2;
(4)第一组实验数据消耗的酸性高锰酸钾溶液体积偏大,
A.酸式滴定管用蒸馏水洗净后未用标准液润洗,导致标准液被稀释,标准液浓度减小;
B.达到过程中锥形瓶不需要干燥,不影响待测液中溶质的物质的量;
C.滴定终了仰视读数,读出的是凹液面下方读数,读数比实际消耗的标准液体积偏大;
(5)第一组数据舍弃,计算出其它3组消耗标准液的平均体积,再结合反应方程式计算出样品中亚硝酸钠的质量及质量分数.
解答 解:(1)装置A烧瓶中,碳和浓硝酸反应生成二氧化碳、二氧化氮和水,反应的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,装置B中二氧化氮通入和水反应生成硝酸,硝酸具有强氧化性能氧化铜生成硝酸铜溶液同时生成一氧化氮气体,装置B中的现象是B中溶液由无色变为蓝色,铜片表面有气泡产生,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;B中溶液由无色变为蓝色,铜片表面有气泡产生;
(2)为避免装置中的空气导致产品不纯,需要打开弹簧夹通入氮气排净装置中的空气,防止C中产生NaNO3,
故答案为:排尽装置中的空气,防止C中产生NaNO3;
(3)有同学认为装置c中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,化学式为:Na2CO3 NaOH NaNO3,那么NO中混有CO2、NO2,可以在B、C之间增加装有碱石灰或生石灰的装置E,以吸收杂质CO2、NO2,
故答案为:Na2CO3 NaOH NaNO3;B;
(4)第一组实验数据消耗的酸性高锰酸钾溶液体积偏大,会导致测量结果偏高,
A.酸式滴定管用蒸馏水洗净后未用标准液润洗,导致标准液被稀释,滴定过程中消耗的标准液体积会偏大,故A正确;
B.锥形瓶不需要干燥,所以锥形瓶洗净后未干燥,不影响测定结果,故B错误;
C.滴定终了仰视读数,导致读数偏大,计算出的标准液体积偏大,故C正确;
故答案为:AC;
(5)由于第一组数据偏高,应该舍弃;其它三组消耗标准液平均体积为:$\frac{20.02+20.00+19.98}{3}$mL=20.00mL,
25mL样品消耗高锰酸钾的物质的量为:0.1000mol/L×0.02L=0.002mol,则250mL样品溶液会消耗高锰酸钾的物质的量为:0.002mol×$\frac{250ml}{25ml}$=0.02mol,根据化合价变化可得反应关系式:2MnO4-~5NO2-,则4.000g样品中含有亚硝酸钠的物质的量为:0.02mol×$\frac{5}{2}$=0.05mol,质量为69g/mol×0.05mol=3.45g,所以反应后的固体中亚硝酸钠的质量分数为:$\frac{3.45g}{4.000g}$×100%=86.25%,
故答案为:86.25%或0.8625.
点评 本题考查实验方案的设计和探究,考查学生分析和解决问题的能力,涉及化学方程式的书写、物质含量的计算以及电解原理,综合性强,题目难度不大.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | CO2和HCOOH均属于弱电解质 | B. | CO2和HCOOH均属于有机化合物 | ||
| C. | CO2转变为HCOOH发生还原反应 | D. | 1mol CO2的体积一定等于22.4L |
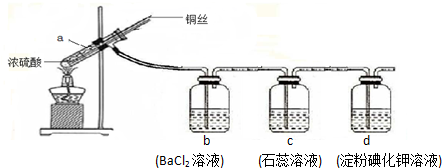
| A. | a装置中有白色固体 | B. | b装置中产生白色沉淀 | ||
| C. | c装置中溶液先变红后褪色 | D. | d装置中溶液变蓝色 |
| A. | CH4、N2、CO2均属于非电解质 | B. | NO2、CO2、H2O均属于氧化物 | ||
| C. | CH4、NO2、CO2均属于非极性分子 | D. | 该反应属于置换反应 |
| A. | 原子半径由大到小的顺序:W、Y、Z、X | |
| B. | 简单气态氢化物的稳定性由强到弱的顺序:Y、Z、W | |
| C. | 在化合物Y2X2、Z2X4分子中含有的共用电子对数相等 | |
| D. | 在元素W、Y、Z中,最高价氧化物的水化物酸性最强的是W |
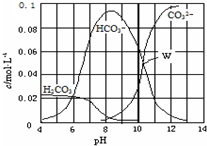
| A. | W点所示的溶液:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) | |
| B. | pH=4的溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1 mol•L-1 | |
| C. | 向pH=8的溶液中通入CO2至pH=7所得的溶液:c(Na+)>c(Cl-)+c(HCO3-)+c(H2CO3) | |
| D. | pH=11的溶液:c(Na+)+2c(H2CO3)>2c(Cl-)+2c(CO32-) |
| A. | 漂粉精 | B. | 氨气 | C. | 烧碱 | D. | 纯碱 |
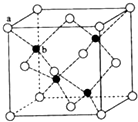 E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为Nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为Nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.