题目内容
2.以白云石(化学式表示为MgCO3•CaCO3)为原料制备氢氧化镁的工艺流程如图1: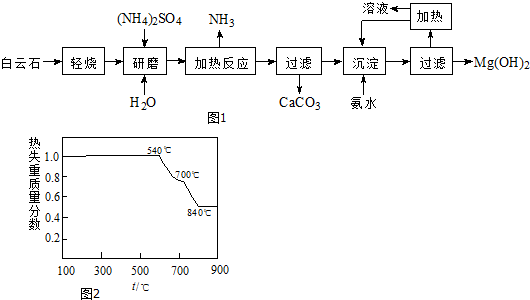
(1)根据流程图1和图2热分解图判断白云石“轻烧”后固体产物的主要成份CaCO3、MgO.则“轻烧”温度应不超过700℃.
(2)流程图中“加热反应”的化学方程式为(NH4)2SO4+MgO$\frac{\underline{\;\;△\;\;}}{\;}$MgSO4+2NH3↑+H2O.
(3)沉淀过程溶液的pH=10,此时溶液中c(Mg2+)=5.61×10-4mol•L-1.(已知Ksp[Mg(OH)2]=5.61×10-12)
(4)该工艺中可以循环使用的物质是(NH4)2SO4、NH3或NH3•H2O(填化学式).
(5)传统工艺将白云石分解为氧化镁和氧化钙后提取,该工艺采用轻烧白云石的方法,其优点是①减少能源消耗、②便于CaCO3分离.
分析 白云石主要成分为MgCO3•CaCO3轻烧,从过滤中可以得到CaCO3来进行判断,可知分解的只是碳酸镁,研磨加入水和硫酸铵加热,硫酸铵和氧化镁反应生成氨气、硫酸镁和水,过滤后在滤液中加入氨水生成氢氧化镁沉淀,过滤得到氢氧化镁固体,
(1)从过滤中可以得到CaCO3来进行判断,可知分解的只是碳酸镁;从表中可以看出,温度低于540℃时,物质不分解,高于840℃时,碳酸钙和碳酸镁都分解,因此该温度不超过700℃;
(2)加热的过程是放出氨气的过程,该过程中因为氧化镁跟水反应很少,因此涉及到的反应应该为:(NH4)2SO4+MgO$\frac{\underline{\;\;△\;\;}}{\;}$MgSO4+2NH3↑+H2O;
(3)pH=10时,溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=10-4 mol/L,c(Mg2+)=$\frac{{K}_{sp}[Mg(OH)_{2}]}{{c}^{2}(O{H}^{-})}$;
(4)该工艺中可以循环使用的物质是参加反应过程,反应后又生成的物质可以循环使用;
(5)减少能源消耗、便于CaCO3分离.
解答 解:白云石主要成分为MgCO3•CaCO3轻烧,从过滤中可以得到CaCO3来进行判断,可知分解的只是碳酸镁,研磨加入水和硫酸铵加热,硫酸铵和氧化镁反应生成氨气、硫酸镁和水,过滤后在滤液中加入氨水生成氢氧化镁沉淀,过滤得到氢氧化镁固体,
(1)从过滤中可以得到CaCO3来进行判断,可知分解的只是碳酸镁,碳酸钙不分解,则“轻烧”后得到的固体是CaCO3、MgO;从表中可以看出,温度低于540℃时,物质不分解,高于840℃时,碳酸钙和碳酸镁都分解,因此该温度不超过700℃,
故答案为:CaCO3、MgO; 700℃;
(2)加热的过程是放出氨气的过程,该过程中因为氧化镁跟水反应很少,涉及到的反应应该为(NH4)2SO4+MgO$\frac{\underline{\;\;△\;\;}}{\;}$MgSO4+2NH3↑+H2O,
故答案为:(NH4)2SO4+MgO$\frac{\underline{\;\;△\;\;}}{\;}$MgSO4+2NH3↑+H2O;
(3)pH=10时,溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=10-4 mol/L,c(Mg2+)=$\frac{{K}_{sp}[Mg(OH)_{2}]}{{c}^{2}(O{H}^{-})}$=$\frac{5.61×1{0}^{-12}}{(1{0}^{-4})^{2}}$mol/L=5.61×10-4mol•L-1,
故答案为:5.61×10-4mol•L-1 ;
(4)该工艺中可以循环使用的物质是参加反应过程,反应后又生成的物质可以循环使用,流程图分析判断(NH4)2SO4 、NH3或NH3•H2O可以循环使用,
故答案为:(NH4)2SO4、NH3或NH3•H2O;
(5)分析流程可知,传统工艺将白云石分解为氧化镁和氧化钙后提取,该工艺采用轻烧白云石的方法可以减少能源消耗、便于CaCO3分离;
故答案为:减少能源消耗;便于CaCO3分离.
点评 本题考查了物质分离方法和流程理解应用,为高频考点,侧重于学生的分析能力和实验能力的考查,题目涉及混合物分离提纯、产物的分析判断,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | “84”消毒液有漂白和消毒作用 | |
| B. | 工业中将氯气通入石灰乳中制取漂白粉 | |
| C. | 漂白粉的有效成分是CaCl2和Ca(ClO)2 | |
| D. | 漂白粉在空气中久置失效 |
 在其他条件不变时,改变某一条件对反应A2(g)+3B2(g)?2AB3(g)的化学平衡状态的影响如图所示(T表示温度,n表示物质的量).下列判断正确的是( )
在其他条件不变时,改变某一条件对反应A2(g)+3B2(g)?2AB3(g)的化学平衡状态的影响如图所示(T表示温度,n表示物质的量).下列判断正确的是( )| A. | 反应速率:a>b>c | B. | 达到平衡时A的转化率大小:b>a>c | ||
| C. | 若T2>T1.则正反应一定是吸热反应 | D. | 达到平衡时,n( AB3)的大小:b>a>c |
| A. | MnS使用量越大,废水中的Cu2+的去除率越高 | |
| B. | 该反应可将工业废水中的Cu2+沉淀完全 | |
| C. | 往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 | |
| D. | 该反应的平衡常数K=2.0×1023 |
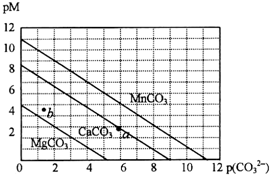 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示.已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示.已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-).下列说法正确的是( )| A. | M离子浓度越大,pM值越大 | |
| B. | MgCO3、CaCO3、MnCO3的Ksp依次增大 | |
| C. | b点表示MgCO3为不饱和溶液,若表示CaCO3则有沉淀析出 | |
| D. | a点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
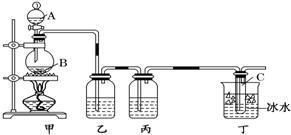
 某化学课外小组用右图装置制取溴苯并探究该反应的类型.先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中.
某化学课外小组用右图装置制取溴苯并探究该反应的类型.先向分液漏斗中加入苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中. .
.