题目内容
下列说法正确的是( )
| A、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B、HClO是弱酸,所以NaClO是弱电解质 |
| C、HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D、杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质 |
考点:电解质与非电解质,强电解质和弱电解质的概念
专题:电离平衡与溶液的pH专题
分析:A.电解质是水溶液中或熔融状态下能导电的化合物,注意导电是由于自身的电离;
B.NaClO属于盐,在水中能完全电离是强电解质;
C.HCl中只含共价键,NaCl中只含离子键;
D.钠盐都是强电解质.
B.NaClO属于盐,在水中能完全电离是强电解质;
C.HCl中只含共价键,NaCl中只含离子键;
D.钠盐都是强电解质.
解答:
解:A.SO3溶于水后能导电是因为和水反应生成的H2SO4能电离,和SO3本身无关,是非电解质,故A不选;
B.NaClO属于盐,在水中能完全电离是强电解质,故B不选;
C.HCl中只含共价键,NaCl中只含离子键,则HCl为共价化合物,而NaCl为离子化合物,不能利用溶液的导电性判断化合物的类别,故C不选;
D.钠盐都是强电解质,所以杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质,故D选;
故选D.
B.NaClO属于盐,在水中能完全电离是强电解质,故B不选;
C.HCl中只含共价键,NaCl中只含离子键,则HCl为共价化合物,而NaCl为离子化合物,不能利用溶液的导电性判断化合物的类别,故C不选;
D.钠盐都是强电解质,所以杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质,故D选;
故选D.
点评:本题为综合题型,考查电解质、电解质强弱的判断,化合物类型的判断,题目难度中等,注意理解电解质强弱的判断依据.

练习册系列答案
相关题目
下列各组离子能在指定环境中大量共存的是( )
| A、在C(HCO3-)=0.1mol/L的溶液中NH4+、Al3+、Cl-、NO3- |
| B、在由水电离出的C(H+)=1×10-12mol/L的溶液中AlO2-、HCO3-、Na+、SO42- |
| C、在使红色石蕊试纸变蓝的溶液中SO32-、CO32-、Na+、K+ |
| D、pH=1的溶液中Mg2+、Fe2+、NO3-、Cl- |
合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质.分析下表中的数据,不能形成合金的是( )
| Na | Cu | Al | Fe | |
| 熔点/℃ | 97.8 | 1083 | 660 | 1535 |
| 沸点/℃ | 883 | 2567 | 2467 | 2750 |
| A、Cu和Al |
| B、Fe和Cu |
| C、Cu和Na |
| D、Al和Na |
PH=3的盐酸和醋酸各100mL,分别和锌反应,反应完后,放出的气体一样多.若最后有一溶液中锌剩余,则下列判断正确的是( )
| A、反应开始时速率v(HCl)>v(CH3COOH) |
| B、加入的锌质量相等 |
| C、盐酸中锌有剩余 |
| D、反应开始后不久,醋酸反应的速率小于盐酸 |
 反应aX(g)+bY(g)cZ(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )
反应aX(g)+bY(g)cZ(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )| A、T1<T2,P1<P2,a+b<c正反应是吸热反应 |
| B、T1<T2,P1>P2,a+b<c正反应是吸热反应 |
| C、T1>T2,P1>P2,a+b>c逆反应是吸热反应 |
| D、T1>T2,P1<P2,a+b>c逆反应是吸热反应 |
做罐头的马口铁是在铁的表面上镀上一层既耐腐蚀有无毒的锡,但食用时开启后的罐头易生锈,其所发生的反应正确的是( )
| A、负极Sn-2e→Sn2+ |
| B、正极Fe-2e→Fe2+ |
| C、正极2H2O+O2-2e→4OH- |
| D、负极Fe-2e→Fe2+ |
下列化学方程式或离子方程式正确的是( )
| A、用醋酸去除水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | ||
B、甲醛与足量新制Cu(OH)2浊液反应:HCHO+2Cu(OH)2
| ||
C、实验室用液溴和苯在催化剂作用下制溴苯: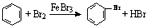 | ||
D、将CO2通入苯酚钠溶液: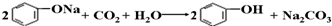 |

