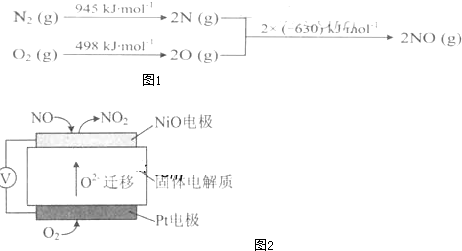
题目内容
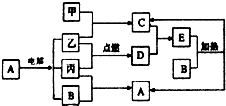 下列如框图2所示的物质转化关系中,甲、乙、丙是常见的气体单质.气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去).
下列如框图2所示的物质转化关系中,甲、乙、丙是常见的气体单质.气体C与气体D相遇产生大量的白烟生成E,A是海水中浓度最高的盐(部分反应物和生成物及水已略去).请回答下列问题:
(1)写出实验室制备C的化学方程式:
(2)E是
(3)写出B和丙生成A的离子反应方程式
(4)工业上可用C的浓溶液吸收某些工厂尾气中的SO2,写出反应成酸式盐的离子方程式:
考点:无机物的推断
专题:推断题
分析:如框图所示的物质转化关系中,甲、乙、丙是常见的气体单质,A是海水中浓度最高的盐,则A氯化钠,所以乙、丙是氢气和氯气,B为氢氧化钠,根据图中转化关系,可知D为氯化氢,气体C与气体D相遇产生大量的白烟生成E,所以C为氨气,E为氯化铵,由甲、乙反应生成C可知,乙为氢气,则甲为氮气,丙为氯气,据此答题;
解答:
解:如框图所示的物质转化关系中,甲、乙、丙是常见的气体单质,A是海水中浓度最高的盐,则A氯化钠,所以乙、丙是氢气和氯气,B为氢氧化钠,根据图中转化关系,可知D为氯化氢,气体C与气体D相遇产生大量的白烟生成E,所以C为氨气,E为氯化铵,由甲、乙反应生成C可知,乙为氢气,则甲为氮气,丙为氯气,
(1)实验室制备氨气的化学方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;
(2)E为氯化铵,是离子化合物,含有铵根离子与氯离子之间是离子键,铵根离子内部氮原子与氢原子之间是共价键,
故答案为:离子;离子键和共价键;
(3)氯气与氢氧化钠反应的离子反应方程式为Cl2+2OH-═H2O+Cl-+ClO-,
故答案为:Cl2+2OH-═H2O+Cl-+ClO-;
(4)工业上可用氨水的浓溶液吸收某些工厂尾气中的SO2,反应成酸式盐的离子方程式为NH3?H2O+SO2=NH4++HSO3-,
故答案为:NH3?H2O+SO2=NH4++HSO3-.
(1)实验室制备氨气的化学方程式为2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
(2)E为氯化铵,是离子化合物,含有铵根离子与氯离子之间是离子键,铵根离子内部氮原子与氢原子之间是共价键,
故答案为:离子;离子键和共价键;
(3)氯气与氢氧化钠反应的离子反应方程式为Cl2+2OH-═H2O+Cl-+ClO-,
故答案为:Cl2+2OH-═H2O+Cl-+ClO-;
(4)工业上可用氨水的浓溶液吸收某些工厂尾气中的SO2,反应成酸式盐的离子方程式为NH3?H2O+SO2=NH4++HSO3-,
故答案为:NH3?H2O+SO2=NH4++HSO3-.
点评:本题主要考查了常见非金属元素及其化合物知识,难度不大,注意抓住框图题的突破口,进行物质推断,是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列系统命名法正确的是( )
| A、2-甲基-4-乙基戊烷 |
| B、2,3-二乙基-2-戊烯 |
| C、2-甲基-3-丁炔 |
| D、对二甲苯 |
下列各组离子能在指定环境中大量共存的是( )
| A、在C(HCO3-)=0.1mol/L的溶液中NH4+、Al3+、Cl-、NO3- |
| B、在由水电离出的C(H+)=1×10-12mol/L的溶液中AlO2-、HCO3-、Na+、SO42- |
| C、在使红色石蕊试纸变蓝的溶液中SO32-、CO32-、Na+、K+ |
| D、pH=1的溶液中Mg2+、Fe2+、NO3-、Cl- |
常温下,下列溶液pH小于7的是( )
| A、CH3COONa |
| B、CuSO4 |
| C、NaOH |
| D、Na2CO3 |
PH=3的盐酸和醋酸各100mL,分别和锌反应,反应完后,放出的气体一样多.若最后有一溶液中锌剩余,则下列判断正确的是( )
| A、反应开始时速率v(HCl)>v(CH3COOH) |
| B、加入的锌质量相等 |
| C、盐酸中锌有剩余 |
| D、反应开始后不久,醋酸反应的速率小于盐酸 |
主族元素X、Y、Z的离子的电子层结构相同,原子半径X>Z,离子半径Y>X,Y和Z能形成离子化合物,由此可判断三种元素的原子序数是( )
| A、X>Y>Z |
| B、Z>Y>X |
| C、Y>X>Z |
| D、X>Z>Y |
 (1)已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
(1)已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol A、B、C、D、E、在一定条件下的转换条件如图所示:
A、B、C、D、E、在一定条件下的转换条件如图所示: