题目内容
(1)已知可逆反应:M(g)+N(g)?P(g)+Q(g)△H>0,请回答下列问题:
①在某温度下,反应物的起始浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为 ;
②若反应温度不变,反应物的起始浓度分别为:c(M)=4mol?L-1,c(N)=a mol?L-1;达到平衡后,c(P)=2mol?L-1,a= ;
(2)甲、乙两瓶氨水的浓度分别为1mol?L-1和0.1mol?L-1,则甲、乙两瓶氨水中c(OH-)之比 (填“大于”、“小于”或“等于”)10,说明理由 .
(3)25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
125℃时,0.1mol/L上述几种溶液加入完全一样的等量锌粒,反应速率从大到小的顺序是 (填序号)
②25℃时,c(H+)相同的上述几种溶液,其物质的量浓度由大到小的顺序是 (填序号)
③25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是 .
①在某温度下,反应物的起始浓度分别为:c(M)=1mol?L-1,c(N)=2.4mol?L-1,达到平衡后,M的转化率为60%,此时N的转化率为
②若反应温度不变,反应物的起始浓度分别为:c(M)=4mol?L-1,c(N)=a mol?L-1;达到平衡后,c(P)=2mol?L-1,a=
(2)甲、乙两瓶氨水的浓度分别为1mol?L-1和0.1mol?L-1,则甲、乙两瓶氨水中c(OH-)之比
(3)25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
| ①H2SO4溶液: HSO4- H++SO42- | ②NaHSO4溶液: HSO4- H++SO42- | ③盐酸 HCl=H++Cl |
| 10% | 29% | 100% |
②25℃时,c(H+)相同的上述几种溶液,其物质的量浓度由大到小的顺序是
③25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是
考点:化学平衡的计算,电解质在水溶液中的电离
专题:化学平衡专题,电离平衡与溶液的pH专题
分析:(1)依据化学平衡三段式列式计算,达到平衡后,M的转化率为60%,反应浓度=1mol?L-1×60%=0.6mol;
M(g)+N(g)?P(g)+Q(g)
起始量(mol/L) 1 2.4 0 0
变化量(mol/L) 0.6 0.6 0.6 0.6
平衡量(mol/L)0.4 1.8 0.6 0.6
①转化率=
×100%;
②依据三段式列式计算;
(2)根据弱电解质的浓度越小,电离程度越大,则乙中的电离程度大,故甲、乙两瓶氨水中[OH-]之比小于10;
(3)①C(H+)=C(酸)×α(电离度),注意硫酸分两步电离,依据溶液中氢离子浓度大小分析判断反应速率大小;
②等pH的酸,其电离程度越大,酸的物质的量浓度越小;
③电离时含有相同的离子能抑制酸电离.
M(g)+N(g)?P(g)+Q(g)
起始量(mol/L) 1 2.4 0 0
变化量(mol/L) 0.6 0.6 0.6 0.6
平衡量(mol/L)0.4 1.8 0.6 0.6
①转化率=
| 消耗量 |
| 起始量 |
②依据三段式列式计算;
(2)根据弱电解质的浓度越小,电离程度越大,则乙中的电离程度大,故甲、乙两瓶氨水中[OH-]之比小于10;
(3)①C(H+)=C(酸)×α(电离度),注意硫酸分两步电离,依据溶液中氢离子浓度大小分析判断反应速率大小;
②等pH的酸,其电离程度越大,酸的物质的量浓度越小;
③电离时含有相同的离子能抑制酸电离.
解答:
解:(1)达到平衡后,M的转化率为60%,反应浓度=1mol?L-1×60%=0.6mol;
M(g)+N(g)?P(g)+Q(g)
起始量(mol/L) 1 2.4 0 0
变化量(mol/L) 0.6 0.6 0.6 0.6
平衡量(mol/L)0.4 1.8 0.6 0.6
K=
=0.5
①N的转化率=
×100%=
×100%=25%,故答案为:25%;
②起始量=消耗量+平衡量,则
M(g)+N(g)?P(g)+Q(g)
起始量(mol/L) 4 a 0 0
变化量(mol/L) 2 2 2 2
平衡量(mol/L) 2 a-2 2 2
=0.5
a=6mol/L;
故答案为:6 mol/L;
(2)甲、乙两瓶氨水的浓度分别为1摩/升和0.1摩/升,则甲瓶氨水的浓度是乙瓶氨水的浓度的10倍,又弱电解质的浓度越小,电离程度越大,故甲瓶氨水的电离度比乙瓶氨水的电离度小,所以甲、乙两瓶氨水中[OH-]之比小于10;
故答案为:小于;氨水浓度越小,电离度越大;
(3)①硫酸第一步完全电离,第二步部分电离,硫酸中C(H+)=(0.1+0.1×10%)mol/L=0.11mol/L;
硫酸氢钠溶液中,C(H+)=(0.1×29%)mol/L=0.029mol/L;
醋酸溶液中,C(H+)=(0.1×1.33%)mol/L=0.00133mol/L;
盐酸溶液中,C(H+)=0.1mol/L;所以C(H+)由大到小的顺序是①③②,0.1mol/L上述几种溶液加入完全一样的等量锌粒,反应速率从大到小的顺序是:①>③>②;
故答案为:①③②;
②c(H+)相同的上述几种溶液,其电离程度越大,则需要的酸的物质的量浓度越小,根据表中数据可知,电离程度大小为:②<③<①,则物质的量浓度由大到小的顺序是②>③>①;
故答案为:②>③>①;
③硫酸溶液中,硫酸第一步电离出氢离子,第二步又电离出氢离子,第一步电离出的氢离子抑制了第二步的电离,而硫酸氢钠溶液中硫酸氢根离子只有一步电离,所以.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度,
故答案为:硫酸的第一步电离抑制了硫酸氢根离子的电离.
M(g)+N(g)?P(g)+Q(g)
起始量(mol/L) 1 2.4 0 0
变化量(mol/L) 0.6 0.6 0.6 0.6
平衡量(mol/L)0.4 1.8 0.6 0.6
K=
| 0.6×0.6 |
| 0.4×1.8 |
①N的转化率=
| 消耗量 |
| 起始量 |
| 0.6mol/L |
| 2.4mol/L |
②起始量=消耗量+平衡量,则
M(g)+N(g)?P(g)+Q(g)
起始量(mol/L) 4 a 0 0
变化量(mol/L) 2 2 2 2
平衡量(mol/L) 2 a-2 2 2
| 22 |
| 2×(a-2) |
a=6mol/L;
故答案为:6 mol/L;
(2)甲、乙两瓶氨水的浓度分别为1摩/升和0.1摩/升,则甲瓶氨水的浓度是乙瓶氨水的浓度的10倍,又弱电解质的浓度越小,电离程度越大,故甲瓶氨水的电离度比乙瓶氨水的电离度小,所以甲、乙两瓶氨水中[OH-]之比小于10;
故答案为:小于;氨水浓度越小,电离度越大;
(3)①硫酸第一步完全电离,第二步部分电离,硫酸中C(H+)=(0.1+0.1×10%)mol/L=0.11mol/L;
硫酸氢钠溶液中,C(H+)=(0.1×29%)mol/L=0.029mol/L;
醋酸溶液中,C(H+)=(0.1×1.33%)mol/L=0.00133mol/L;
盐酸溶液中,C(H+)=0.1mol/L;所以C(H+)由大到小的顺序是①③②,0.1mol/L上述几种溶液加入完全一样的等量锌粒,反应速率从大到小的顺序是:①>③>②;
故答案为:①③②;
②c(H+)相同的上述几种溶液,其电离程度越大,则需要的酸的物质的量浓度越小,根据表中数据可知,电离程度大小为:②<③<①,则物质的量浓度由大到小的顺序是②>③>①;
故答案为:②>③>①;
③硫酸溶液中,硫酸第一步电离出氢离子,第二步又电离出氢离子,第一步电离出的氢离子抑制了第二步的电离,而硫酸氢钠溶液中硫酸氢根离子只有一步电离,所以.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度,
故答案为:硫酸的第一步电离抑制了硫酸氢根离子的电离.
点评:本题考查了化学平衡计算方法的分析应用,弱电解质的电离,主要是三段式列式计算方法的应用,注意硫酸实际上是分两步电离的,且第二步是不完全电离,为易错点.掌握基础是关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A、0.1mol Fe 与0.1mol Cl2充分反应,转移的电子数为0.3 NA |
| B、常温常压下,1mol的氦气和氢气混合气,含有的核外电子数为2NA |
| C、25℃时,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2 NA |
| D、标准状况下,2.24L CCl4和CH2O的混合物中含有NA个碳原子 |
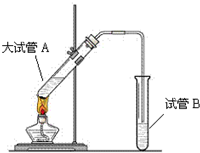 “酒是陈年的香”,是因为乙醇被少量氧气氧化,氧化产物与乙醇反应生成有香味的物质,实验室可以模拟后一过程.
“酒是陈年的香”,是因为乙醇被少量氧气氧化,氧化产物与乙醇反应生成有香味的物质,实验室可以模拟后一过程.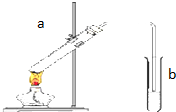 用如图所示的装置制取乙酸乙酯.回答下列问题:
用如图所示的装置制取乙酸乙酯.回答下列问题: