题目内容
化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外能层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层;Z与X在周期表中位于同一主族.回答下列问题:
(1)X的电子排布式为 ,Y的轨道表示式为 ;
(2)ZX2的分子式是 ,分子构型为 .YX2的电子式是 ,分子构型为 ,中心原子发生了 杂化.
(3)Y与Z形成的化合物的分子式是 ,该化合物中化学键是 键(填“极性”或“非极性”),该分子属于 分子(填“极性”或“非极性”).
(4)Y的氢化物中分子构型为正四面体的是 (填名称),键角为 ,中心原子的杂化形式为 .
(5)X的氢化物的分子构型为 ,键角为 ,中心原子的杂化形式 .
(1)X的电子排布式为
(2)ZX2的分子式是
(3)Y与Z形成的化合物的分子式是
(4)Y的氢化物中分子构型为正四面体的是
(5)X的氢化物的分子构型为
考点:原子核外电子排布,电子式,判断简单分子或离子的构型,极性键和非极性键
专题:化学键与晶体结构
分析:化合物YX2、ZX2中X、Y、Z的核电荷数小于18,三元素处于短周期,Y原子的最外层中p能级的电子数等于前一能层电子总数,Y原子只能有2个能层,核外电子排布为1s22s2p2,故Y为碳元素;X原子最外能层的p能级中有一个轨道充填了2个电子,外围电子排布为ns2np4,处于ⅥA族,且X和Y具有相同的电子层数,故X为O元素;Z与X在周期表中位于同一主族,则Z为S元素,据此解答.
解答:
解:化合物YX2、ZX2中X、Y、Z的核电荷数小于18,三元素处于短周期,Y原子的最外层中p能级的电子数等于前一能层电子总数,Y原子只能有2个能层,核外电子排布为1s22s2p2,故Y为碳元素;X原子最外能层的p能级中有一个轨道充填了2个电子,外围电子排布为ns2np4,处于ⅥA族,且X和Y具有相同的电子层数,故X为O元素;Z与X在周期表中位于同一主族,则Z为S元素,
(1)由上述分析可知,X为O元素,其电子排布式为1s22s2p4,Y为C元素,原子核外电子排布为1s22s2p2,故其轨道表示式为 ;
;
故答案为:1s22s2p4; ;
;
(2)由上述分析可知,ZX2的分子式是SO2,SO2的分子中价层电子对个数是2+
(6-2×2)=3,且含有一个孤电子对,所以其空间构型为V型,YX2为CO2,分子中C原子与O原子之间形成2对共用电子对,杂化方式为SP杂化,分子为直线型,其电子式是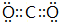 ;
;
故答案为:SO2;V形;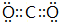 ;直线形;SP;
;直线形;SP;
(3)C与S形成的化合物是CS2,CS2中碳原子和硫原子之间存在极性键,但CS2分子中正负电荷重心重合,为非极性分子;
故答案为:CS2;极性键;非极性;
(4)Y的氢化物中分子构型为正四面体的是甲烷,甲烷分子中碳原子含有4个共价单键,且不含孤电子对,所以碳原子为sp3杂化,所以分子为正四面体型,键角为109°28′;
故答案为:甲烷;109°28′;sp3;
(5)O的最简单氢化物是水,水分子是V形结构,水分子中中键角为105°,水分子中O原子含有2个共价单键,有两对孤电子对,所以O原子为sp3杂化.
故答案为:V形;105°;sp3.
(1)由上述分析可知,X为O元素,其电子排布式为1s22s2p4,Y为C元素,原子核外电子排布为1s22s2p2,故其轨道表示式为
 ;
;故答案为:1s22s2p4;
 ;
;(2)由上述分析可知,ZX2的分子式是SO2,SO2的分子中价层电子对个数是2+
| 1 |
| 2 |
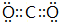 ;
;故答案为:SO2;V形;
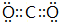 ;直线形;SP;
;直线形;SP;(3)C与S形成的化合物是CS2,CS2中碳原子和硫原子之间存在极性键,但CS2分子中正负电荷重心重合,为非极性分子;
故答案为:CS2;极性键;非极性;
(4)Y的氢化物中分子构型为正四面体的是甲烷,甲烷分子中碳原子含有4个共价单键,且不含孤电子对,所以碳原子为sp3杂化,所以分子为正四面体型,键角为109°28′;
故答案为:甲烷;109°28′;sp3;
(5)O的最简单氢化物是水,水分子是V形结构,水分子中中键角为105°,水分子中O原子含有2个共价单键,有两对孤电子对,所以O原子为sp3杂化.
故答案为:V形;105°;sp3.
点评:点评:本题考查了元素位置、结构和性质的相互关系及应用,涉及电子式的书写、分子极性的判断、分子空间构型的判断等知识点,明确短周期元素原子结构是解本题关键,根据原子之间的关系确定元素,再结合物质的结构和性质解答,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
以下关于元素周期表结构的叙述正确的是( )
| A、元素周期表有7个主族,8个副族 |
| B、元素周期表有3个长周期、4个短周期 |
| C、第ⅢA族位于元素周期表的第三列(从左往右) |
| D、0族位于元素周期表的第18列(从左往右) |
 表示(其中X、Y均不为H),且能发生银镜反应的物质有
表示(其中X、Y均不为H),且能发生银镜反应的物质有
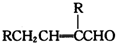
 某化学研究小组拟采用铜粉在酸溶液中直接通入空气氧化制备硫酸铜晶体.
某化学研究小组拟采用铜粉在酸溶液中直接通入空气氧化制备硫酸铜晶体.