��Ŀ����
�ϳɰ���ҵ�IJ��ֹ�����������ͼ��ʾ��
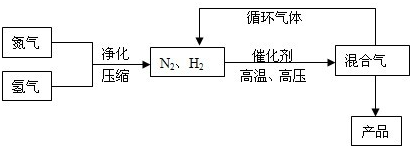
����ش��������⣺
��1����֪��N2��g��+O2��g���T2NO��g������H=180.5kJ?mol-1
4NH3��g��+5O2��g���T4NO��g��+6H2O��g������H=-905kJ?mol-1
2H2��g��+O2��g���T2H2O��g������H=-483.6kJ?mol-1
��N2��g��+3H2��g��?2NH3��g���ġ�H= ��
��2���ı�������������ʹƽ��������Ӧ���������ƽ�ⳣ��������� ��
A������ѹǿ B�������¶� C��ʹ�ô��� D������Ӧ���Ũ��
��3����һ�������£���2molN2��5molH2�����һ��10L���ܱ������У���Ӧ�����ͼ1��ʾ��
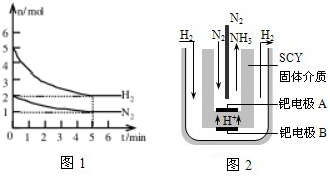
����5min�ڵ�ƽ����Ӧ����v��NH3��=
�ڴﵽƽ��ʱNH3���������Ϊ %
��4����������ѧ������˵��ϳɰ��ķ��������ø����ӵ����Ե�SCY�մɣ��ܴ���H+��Ϊ���ʣ�������������������ϵĽ����ٶྦྷ��Ĥ���缫��ʵ���˸�ת���ʵĵ�ⷨ�ϳɰ���װ����ͼ2��
��ش��ٵ缫A�ǵ��ص� ��������������������ü��ϵĵ缫��Ӧʽ�� ��

����ش��������⣺
��1����֪��N2��g��+O2��g���T2NO��g������H=180.5kJ?mol-1
4NH3��g��+5O2��g���T4NO��g��+6H2O��g������H=-905kJ?mol-1
2H2��g��+O2��g���T2H2O��g������H=-483.6kJ?mol-1
��N2��g��+3H2��g��?2NH3��g���ġ�H=
��2���ı�������������ʹƽ��������Ӧ���������ƽ�ⳣ���������
A������ѹǿ B�������¶� C��ʹ�ô��� D������Ӧ���Ũ��
��3����һ�������£���2molN2��5molH2�����һ��10L���ܱ������У���Ӧ�����ͼ1��ʾ��

����5min�ڵ�ƽ����Ӧ����v��NH3��=
�ڴﵽƽ��ʱNH3���������Ϊ
��4����������ѧ������˵��ϳɰ��ķ��������ø����ӵ����Ե�SCY�մɣ��ܴ���H+��Ϊ���ʣ�������������������ϵĽ����ٶྦྷ��Ĥ���缫��ʵ���˸�ת���ʵĵ�ⷨ�ϳɰ���װ����ͼ2��
��ش��ٵ缫A�ǵ��ص�
���㣺��ҵ�ϳɰ�,�ø�˹���ɽ����йط�Ӧ�ȵļ���,ԭ��غ͵��صĹ���ԭ��,��ѧƽ���Ӱ������,��ѧƽ��ļ���
ר�⣺��ѧ��Ӧ�е������仯,��ѧƽ��ר��,�绯ѧר��
��������1�����ݸ�˹���������㷴Ӧ���ʱ䣻
��2�����ݻ�ѧƽ���ƶ�ԭ���Լ�ƽ�ⳣ��ֻ���¶�Ӱ�����ش�
��3�����ݻ�ѧ����ʽ���á����м��㷨�������㣻
��4�����ݵ��صĹ���ԭ�������������������������Ϸ����õ��ӵĻ�ԭ��Ӧ���ش�
��2�����ݻ�ѧƽ���ƶ�ԭ���Լ�ƽ�ⳣ��ֻ���¶�Ӱ�����ش�
��3�����ݻ�ѧ����ʽ���á����м��㷨�������㣻
��4�����ݵ��صĹ���ԭ�������������������������Ϸ����õ��ӵĻ�ԭ��Ӧ���ش�
���
�⣺��1����֪����N2��g��+O2��g��=2NO��g������H=180.5kJ?mol-1
��4NH3��g��+5O2��g��=4NO��g��+6H2O��g������H=-905kJ?mol-1
��2H2��g��+O2��g��=2H2O��g������H=-483.6kJ?mol-1
��ӦN2��g��+3H2��g��?2NH3��g�����ڢ�+�ۡ�
-�ڡ�
�����ԡ�H=��H1+��H3��
-
��H2=-92.4kJ?mol-1��
�ʴ�Ϊ��-92.4kJ?mol-1��
��2��ƽ�ⳣ��ֻ���¶�Ӱ�죬ƽ�ⳣ������˵���¶Ȳ��䣬����B����ʹ�ô���ֻ�ܸı䷴Ӧ���ʣ���������Ӧ���ƶ�����C������ƽ���ƶ�ԭ��������ѹǿ������Ӧ���Ũ�Ⱦ���ʹƽ�������ƶ����ʴ�Ϊ��AD��
��3������5min�����ɰ��������ʵ���Ũ��Ϊx����
N2��g��+3H2��g��?2NH3��g��
��ʼŨ�ȣ�0.2 0.5 0
�仯Ũ�ȣ�0.5x 1.5x x
ƽ��Ũ�ȣ�0.2-0.5x 0.5-1.5x x
��������x=0.2��mol/L��
����5min�ڵ�ƽ����Ӧ����v��NH3��=
=0.04mol/��L?min�����ʴ�Ϊ��0.04mol/��L?min����
�ڴﵽƽ��ʱNH3���������=
��100%=40%���ʴ�Ϊ��40%��
��4������ͼʾ��Ϣ��������������������֪�ٵ缫�����������������õ��ӵĻ�ԭ��Ӧ����N2+6e-+6H+=2NH3���ʴ�Ϊ������N2+6e-+6H+=2NH3��
��4NH3��g��+5O2��g��=4NO��g��+6H2O��g������H=-905kJ?mol-1
��2H2��g��+O2��g��=2H2O��g������H=-483.6kJ?mol-1
��ӦN2��g��+3H2��g��?2NH3��g�����ڢ�+�ۡ�
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
�ʴ�Ϊ��-92.4kJ?mol-1��
��2��ƽ�ⳣ��ֻ���¶�Ӱ�죬ƽ�ⳣ������˵���¶Ȳ��䣬����B����ʹ�ô���ֻ�ܸı䷴Ӧ���ʣ���������Ӧ���ƶ�����C������ƽ���ƶ�ԭ��������ѹǿ������Ӧ���Ũ�Ⱦ���ʹƽ�������ƶ����ʴ�Ϊ��AD��
��3������5min�����ɰ��������ʵ���Ũ��Ϊx����
N2��g��+3H2��g��?2NH3��g��
��ʼŨ�ȣ�0.2 0.5 0
�仯Ũ�ȣ�0.5x 1.5x x
ƽ��Ũ�ȣ�0.2-0.5x 0.5-1.5x x
��������x=0.2��mol/L��
����5min�ڵ�ƽ����Ӧ����v��NH3��=
| 0.2mol/L |
| 5min |
�ڴﵽƽ��ʱNH3���������=
| 0.2 |
| 0.5 |
��4������ͼʾ��Ϣ��������������������֪�ٵ缫�����������������õ��ӵĻ�ԭ��Ӧ����N2+6e-+6H+=2NH3���ʴ�Ϊ������N2+6e-+6H+=2NH3��
������������һ����ѧ��ҵ������ϵ����Ŀ��Ҫ��ѧ����ǽ̲�֪ʶ�������Լ������ͽ��������������ѶȽϴ�

��ϰ��ϵ�д�
�����Ŀ
�������ӷ���ʽ��ѧ����ʽ��������ʵ�������ȷ���ǣ�������
| A����2molSO3����ͨ��һ�ܱ������У���ƽ�������QkJ��������2SO3��g��?2SO2��g��+O2��g����H=+Q KJ/mol |
| B������0.4molFeBr2����Һ��ͨ��0.2molCl2��ַ�Ӧ��2Fe2++Cl2=2Fe3++2Cl- |
| C��NH4Al��SO4��2��Һ�м���Ba��OH��2��ҺʹSO42-��ȫ������Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4��+2H2O |
| D����FeCl3������Һ�����ˮ����ȡFe��OH��3���壺Fe3++3H2O?Fe��OH��3��+3H+ |
���»�̬ԭ�ӵĵ����Ų�ʽ�����Ϲ���ԭ�����ǣ�������
| A��1s22s22p63s23p63d74s2 |
| B��1s22s22p63s23p63d54s1 |
| C��1s22s22p63s23p63d104s24p1 |
| D��1s22s22p63s23p64s2 |
����˵����ȷ���ǣ�������
| A�����еķ��ȷ�Ӧ�����ڳ��³�ѹ���Է����� |
| B��Ba��OH��2?8H2O��NH4Cl��Ӧ���ڷ��ȷ�Ӧ |
| C����Ȼ��ȼ��ʱ���仯ѧ��ȫ��ת��Ϊ���� |
| D����Ӧ��ֻ�뷴Ӧ��ϵ��ʼ̬����̬�йأ����뷴Ӧ��;���� |
 ����ͼװ���У���ƿ�г�����������a������ͷ�ι��е�Һ��b������ƿ�ڣ���������ƿ��Ȼ����ɼ�f���ձ��е�Һ��b����Ȫ״��������ռ���������ƿ��a��b�ֱ�����ǣ�������
����ͼװ���У���ƿ�г�����������a������ͷ�ι��е�Һ��b������ƿ�ڣ���������ƿ��Ȼ����ɼ�f���ձ��е�Һ��b����Ȫ״��������ռ���������ƿ��a��b�ֱ�����ǣ������� ��ʵ��������Ҳ��������ͼ��ʾ��װ����ȡ�����������ش��������⣺
��ʵ��������Ҳ��������ͼ��ʾ��װ����ȡ�����������ش��������⣺ ��
��  �ķе�
�ķе�