题目内容
 “酒是陈年的香”,是因为乙醇被少量氧气氧化,氧化产物与乙醇反应生成有香味的物质,实验室可以模拟后一过程.
“酒是陈年的香”,是因为乙醇被少量氧气氧化,氧化产物与乙醇反应生成有香味的物质,实验室可以模拟后一过程.根据上图回答问题:
(1)此实验反应的化学方程式是(乙醇中O用O-18标记)
(2)此实验加热的目的是:
(3)加热前向试管A中需要加入
(4)B中盛放的药品为
(5)此实验中浓硫酸的作用为
(6)在实验结束后,欲将制得的产物从其承接液体中分离出来,需要的主要仪器名称为
考点:乙酸乙酯的制取
专题:实验题
分析:(1)根据酯化反应原理酸脱羟基醇脱氢写出反应的化学方程式;
(2)实验中加热试管的目的提供能量,从温度对化学反应速率、化学平衡的影响分析;
(3)液体加热要加碎瓷片,防止暴沸,如果加热一段时间后发现忘记加碎瓷片,应冷却至室温,补加碎瓷片;
(4)依据乙醇能溶于水,乙酸能与碳酸钠反应,乙酸乙酯不溶于水解答;
(5)依据浓硫酸性质分析其在反应中的作用;
(6)根据乙酸乙酯的物理性质进行解答.
(2)实验中加热试管的目的提供能量,从温度对化学反应速率、化学平衡的影响分析;
(3)液体加热要加碎瓷片,防止暴沸,如果加热一段时间后发现忘记加碎瓷片,应冷却至室温,补加碎瓷片;
(4)依据乙醇能溶于水,乙酸能与碳酸钠反应,乙酸乙酯不溶于水解答;
(5)依据浓硫酸性质分析其在反应中的作用;
(6)根据乙酸乙酯的物理性质进行解答.
解答:
解:(1)酯化反应中,羧酸脱去羟基,醇脱去氢原子,所以该反应的化学方程式为:CH3COOH+C2H518OH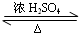 CH3CO18OC2H5+H2O,
CH3CO18OC2H5+H2O,
故答案为:CH3COOH+C2H518OH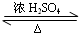 CH3CO18OC2H5+H2O;
CH3CO18OC2H5+H2O;
(2)实验中加热试管,反应的温度高,反应速度快,该反应为可逆反应,温度高,乙酸乙酯的沸点低,易挥发,所以化学平衡向正反应方向移动,利于生成乙酸乙酯,
故答案为:加快反应速率,及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动;
(3)液体加热要加碎瓷片,防止暴沸,如果加热一段时间后发现忘记加碎瓷片,应立即冷却至室温,补加碎瓷片,
故答案为:沸石;防止暴沸;应立即冷却至室温,补加碎瓷片;
(4)乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,所以饱和碳酸钠溶液的作用是除去乙酸乙酯中的乙酸和乙醇,降低乙酸乙酯的溶解度,便于分层,
故答案为:饱和碳酸钠溶液;除去乙酸乙酯中的乙酸和乙醇,降低乙酸乙酯的溶解度,便于分层;
(5)浓硫酸具有吸水性,在酯化反应中起:催化剂和吸水剂的作用,故答案为:催化剂 吸水剂;
(6)乙酸乙酯,其密度比水小,所以在碳酸钠溶液层上方有无色油状液体出现,所以在实验结束后,欲将制得的产物从其承接液体中分离出来,需进行分液,需要的主要仪器名称为分液漏斗,故答案为:分液漏斗.
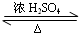 CH3CO18OC2H5+H2O,
CH3CO18OC2H5+H2O,故答案为:CH3COOH+C2H518OH
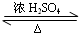 CH3CO18OC2H5+H2O;
CH3CO18OC2H5+H2O;(2)实验中加热试管,反应的温度高,反应速度快,该反应为可逆反应,温度高,乙酸乙酯的沸点低,易挥发,所以化学平衡向正反应方向移动,利于生成乙酸乙酯,
故答案为:加快反应速率,及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动;
(3)液体加热要加碎瓷片,防止暴沸,如果加热一段时间后发现忘记加碎瓷片,应立即冷却至室温,补加碎瓷片,
故答案为:沸石;防止暴沸;应立即冷却至室温,补加碎瓷片;
(4)乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,所以饱和碳酸钠溶液的作用是除去乙酸乙酯中的乙酸和乙醇,降低乙酸乙酯的溶解度,便于分层,
故答案为:饱和碳酸钠溶液;除去乙酸乙酯中的乙酸和乙醇,降低乙酸乙酯的溶解度,便于分层;
(5)浓硫酸具有吸水性,在酯化反应中起:催化剂和吸水剂的作用,故答案为:催化剂 吸水剂;
(6)乙酸乙酯,其密度比水小,所以在碳酸钠溶液层上方有无色油状液体出现,所以在实验结束后,欲将制得的产物从其承接液体中分离出来,需进行分液,需要的主要仪器名称为分液漏斗,故答案为:分液漏斗.
点评:本题考查了乙酸乙酯的制取、物质的分离与提纯,题目难度不大,注意掌握乙酸乙酯的反应原理、装置选择及选用的试剂的作用,明确物质的分离与提纯常用的方法及正确操作方法.

练习册系列答案
相关题目
短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法正确的是( )
| X | Y | ||
| Z | W | Q |
| A、W得电子能力比Q强 |
| B、由Z与Y组成的物质在熔融时能导电 |
| C、钠与Y可能形成Na2Y2化合物 |
| D、X有多种同素异形体,而Y不存在同素异形体 |
以下关于元素周期表结构的叙述正确的是( )
| A、元素周期表有7个主族,8个副族 |
| B、元素周期表有3个长周期、4个短周期 |
| C、第ⅢA族位于元素周期表的第三列(从左往右) |
| D、0族位于元素周期表的第18列(从左往右) |
下列图示与对应的叙述相符的是( )
A、 温度T1>T2,SO2与O2反应过程中的能量变化 |
B、 表示0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/LCH3COOH溶液所得到的滴定曲线 |
C、 表示Zn、Cu和稀硫酸构成的原电池在工作过程中电流强度的变化,T时加入了H2O2 |
D、 表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 |
 如图,在试管a中先加入3mL 95%的乙醇,边摇动边缓缓加入2mL浓H2SO4并充分摇匀,冷却后再加入2mL冰醋酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入3mL 95%的乙醇,边摇动边缓缓加入2mL浓H2SO4并充分摇匀,冷却后再加入2mL冰醋酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验. 在下图装置中,烧瓶中充满干燥气体a,将胶头滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别可以是( )
在下图装置中,烧瓶中充满干燥气体a,将胶头滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别可以是( )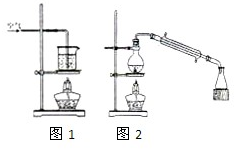 某化学研究小组拟采用铜粉在酸溶液中直接通入空气氧化制备硫酸铜晶体.
某化学研究小组拟采用铜粉在酸溶液中直接通入空气氧化制备硫酸铜晶体.