题目内容
7.甲醇是基本化工原料,甲醇及其可制得产品的沸点如下.| 名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
| 结构式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH | (CH3O)2CO |
| 沸点(℃) | 64.7 | 7.4 | 153℃ | -24.9 | 90℃ |
(2)甲醇合成二甲基甲酰胺的化学方程式为:2CH3OH+NH3+CO?(CH3)2NCHO+2H2O△H若该反应在常温下能自发进行,则该反应为放热反应(填“吸热”、“放热”).
(3)甲醇制甲醚的化学方程式为:2CH3OH?CH3OCH3+H2O△H.一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生该反应.
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
②已知387℃时该反应的化学平衡常数K=4.若起始时向容器I中充入0.1mol CH3OH、0.15mol CH3OCH3和0.10mol H2O,则此时v正>v逆(填“>”、“<”或“=”)
(4)以甲醇为主要原料,电化学合成碳酸二甲酯工作原理如图所示.
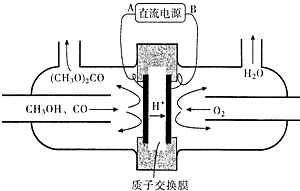
写出阳极的电极反应式2CH3OH+CO-2e-=(CH3O)2CO+2H+.
分析 (1)二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,[(CH3)2NH2+]离子水解溶液显酸性,据此判断溶液中各离子浓度大小;
(2)反应自发进行的判断依据为:△H-T△S<0分析;
(3)①2CH3OH?CH3OCH3+H2O,反应前后物质的量不变,容器Ⅰ,Ⅱ在相同条件下进行,反应前后物质的量不变,起始量Ⅱ为Ⅰ的2倍,生成物质物质的量也为二倍;
②计算此时浓度商,和平衡常数比较方向判断反应进行方向;
(4)图分析可知氢离子移向阴极,则与此电极连接的为负极,阳极上是甲醇和一氧化碳反应失电子发生氧化反应.
解答 解:(1)二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,[(CH3)2NH2+]离子水解溶液显酸性,其水解程度较小,所以溶液中各离子浓度大小为:c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-);
故答案为:c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-);
(2)甲醇合成二甲基甲酰胺的化学方程式为:2CH3OH+NH3+CO?(CH3)2NCHO+2H2O,该反应在常温下能自发进行,△S<0,△H-T△S<0则△H<0,为放热反应,
故答案为:放热;
(3)①2CH3OH?CH3OCH3+H2O,反应前后物质的量不变,容器Ⅰ,Ⅱ在相同条件下进行,反应前后物质的量不变,起始量Ⅱ为Ⅰ的2倍,生成物质物质的量也为二倍,所以x:y=1:2,
故答案为:$\frac{1}{2}$;
②已知387℃时该反应的化学平衡常数K=4.若起始时向容器I中充入0.1mol CH3OH、0.15mol CH3OCH3和0.10mol H2O,浓度商Qc=$\frac{0.15×0.1}{0.{1}^{2}}$=1.5<K=4,则反应将向正反应进行,则正反应速率大于逆反应速率,
故答案为:>;
(4)图分析可知氢离子移向阴极,则与此电极连接的B电极为负极,阳极上是甲醇和一氧化碳反应失电子发生氧化反应,电极反应为:2CH3OH+CO-2e-=(CH3O)2CO+2H+,
故答案为:2CH3OH+CO-2e-=(CH3O)2CO+2H+.
点评 本题考查较综合,涉及电解池原理、化学平衡计算、离子浓度大小比较等知识点,侧重考查学生分析判断及计算能力,明确化学反应原理及物质性质是解本题关键,难点是电极反应式的书写,会根据浓度商与化学平衡常数确定反应方向,题目难度中等.

 口算题天天练系列答案
口算题天天练系列答案| A. | 分子数和气体质量均不同 | B. | 分子数和中子数均相同 | ||
| C. | 质子数和中子数均相同 | D. | 分子数、原子数和质子数均相同 |
| A. | 若HAOm是强酸,则HBOm也一定为强酸 | |
| B. | 若B为非金属元素,则A可能为金属元素,若B为金属元素,则A可能为非金属元素 | |
| C. | 常温下,若B的简单氢化物是气体,则A的简单氢化物可能是液体 | |
| D. | 若B(OH)m是强碱,则A(OH)m也是强碱 |
| A. | 原子半径:B>A,离子半径:C<D | |
| B. | B的单质能与A的最高价氧化物发生置换反应 | |
| C. | 元素B和D能形成BD2型的共价化合物 | |
| D. | D的单质有毒,且有漂白性 |
| A. | 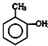 甲基苯酚 甲基苯酚 | |
| B. | 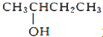 2-羟基丁烷 2-羟基丁烷 | |
| C. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | |
| D. | CH2=CH-CH=CH-CH=CH2 1,3,5-己三烯 |
| A. | 二氧化硅 硅酸盐 | B. | 四氯化硅 硅酸 | ||
| C. | 碳化硅 硅酸钠 | D. | 硅 硅酸盐 |
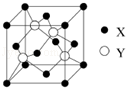 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p 轨道上有4个电子.元素Z 的原子最外层电子数是其内层的3倍.
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p 轨道上有4个电子.元素Z 的原子最外层电子数是其内层的3倍.