题目内容
15.钛(Ti)被誉为“21世纪的金属”,工业上将TiO2与焦炭混合,通入Cl2高温下制得TiCl4;再将TiCl4提纯后,在氩气保护下与镁高温反应制得Ti.其反应如下:①TiO2+2Cl2+2C$\frac{\underline{\;1173K\;}}{\;}$TiCl4+2CO
②TiCl4+2Mg $\frac{\underline{\;1220-1420K\;}}{\;}$Ti+2MgCl2
回答下列问题:
(1)Ti元素原子的价电子排布式为3d24s2;
(2)写出与CO互为等电子体的分子N2;
(3)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃;TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体.
①TiCl4为共价化合物(填“离子”或“共价”);
②TiCl4分子为正四面体形,则Ti为sp3杂化.
③TiCl4在潮湿空气中水解的化学方程式是TiCl4+3H2O=H2TiO3↓+4HCl;
④TiCl2、Cl2和C反应制得的TiCl4最好的提纯方法是蒸馏(填操作名称).
(4)配离子[TiCl(H2O)5]2+的中心离子化合价为+3,中心离子配位数为6.
分析 (1)Ti的原子序数为22,位于周期表中的第四周期第ⅣB族;
(2)等电子体中原子数和价电子数都相同;
(3)①根据题目中提供的物理性质来判断晶体类型从而判断化合物类型;
②可根据分子的构型来判断碳的杂化方式,四面体形属于sp3杂化,平面形中的碳属于sp2杂化,直线形中的碳属于sp杂化;
③TiCl4在潮湿空气中易水解产生白雾,同时产生H2TiO3固体,据此写出方程;
④TiO2、Cl2和C反应制得的TiCl4最好的提纯方法是在氢化氢有氛围中蒸馏;
(4)配离子[TiCl(H2O)5]2+中Cl-、H2O含有孤对电子对是配体,根据离子电荷判断中心离子Tin+的电荷;根据配体数目判断配位数;
解答 解:(1)Ti的原子序数为22,位于周期表中的第四周期第ⅣB族,其电子排布为[Ar]3d24s2,所以Ti元素原子的价电子排布式为3d24s2,故答案为:3d24s2;
(2)等电子体中原子数和价电子数都相同,则 N2、CN-、CO的原子数都是2,价电子数都是10,则互为等电子体,故答案为:N2;
(3)①已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃;,由此可判断 TiCl4是由共价键结合的分子;故答案为:共价;
②TiCl4分子为正四面体形,Ti和Cl形成4个δ键,所以Ti为sp3杂化,故答案为:sp3;
③TiCl4在潮湿空气中易水解产生白雾说明生成HCl,同时产生H2TiO3固体,所以其反应方程式为:TiCl4+3H2O=H2TiO3↓+4HCl,
故答案为:TiCl4+3H2O=H2TiO3↓+4HCl;
④TiO2、Cl2和C反应制得的TiCl4最好的提纯方法是在氢化氢有氛围中蒸馏,故答案为:蒸馏;
(4)配离子[TiCl(H2O)5]2+的中心离子所带的电荷2+1=3,故中心离子为Ti3+,Cl-、H2O含有孤对电子对是配体,配位数是6;
故答案为:+3;6.
点评 本题考查了电子排布式、等电子体、杂化类型的判断、配合物的组成及晶体结构等知识.这些都是高考的热点,是物质结构和性质的重要内容,应熟练掌握.

| A. | 原子序数:a>b>c>d | |
| B. | 离子半径:A(n+1)+>Bn+>C(n+1)->Dn- | |
| C. | 离子氧化性:A(n+1)+>Bn+离子还原性:C(n+1)->Dn- | |
| D. | 单质还原性:A>B,单质氧化性:D>C |
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 由上表可知酸性HCOOH>H2CO3 | |
| B. | 0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1mol/L的NaHCO3溶液中:c(H2CO3)+c(H+)=c(OH-)+c(CO32-) | |
| D. | 结合H+的能力:CO32->HCO3->CN->HCOO- |
已知:
①
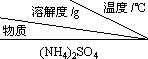 | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.3 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4•FeSO4•6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
Ⅰ.莫尔盐的制取

试分析:
(1)步骤2中加热方式 (填“直接加热”“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是防止Fe2+被氧化,同时热过滤可防止硫酸亚铁以晶体形式析出.
(2)步骤3中包含的实验操作名称加热浓缩、冷却结晶.
(3)产品莫尔盐最后用b洗涤(填字母编号).
a.蒸馏水 b.乙醇 c.滤液
Ⅱ.为测定硫酸亚铁铵(NH4)2SO4FeSO46H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00mL硫酸亚铁铵溶液用0.1000molL -1的酸性KMnO4溶液分三次进行滴定.
(乙)方案二:取20.00mL硫酸亚铁铵溶液进行如下实验.

(1)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为Fe2+已被空气部分氧化,验证推测的方法为:取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化.
(丙)方案三:(通过NH 4+测定)实验设计图如下所示.取20.00mL硫酸亚铁铵溶液进行该实验.
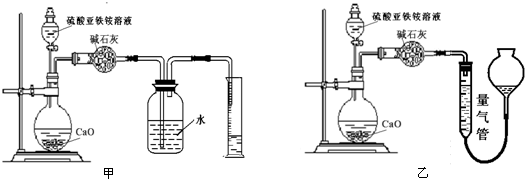
(2)①装置乙(填“甲”或“乙”)较为合理,判断理由是甲装置会出现倒吸.量气管中最佳试剂是 (填字母编号.如选“乙”则填此空,如选“甲”此空可不填).
a.水 b.饱和NaHCO3溶液 c.CCl4
②若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为$\frac{392V×25}{44.8m}$×100%.
| 名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
| 结构式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH | (CH3O)2CO |
| 沸点(℃) | 64.7 | 7.4 | 153℃ | -24.9 | 90℃ |
(2)甲醇合成二甲基甲酰胺的化学方程式为:2CH3OH+NH3+CO?(CH3)2NCHO+2H2O△H若该反应在常温下能自发进行,则该反应为放热反应(填“吸热”、“放热”).
(3)甲醇制甲醚的化学方程式为:2CH3OH?CH3OCH3+H2O△H.一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生该反应.
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
②已知387℃时该反应的化学平衡常数K=4.若起始时向容器I中充入0.1mol CH3OH、0.15mol CH3OCH3和0.10mol H2O,则此时v正>v逆(填“>”、“<”或“=”)
(4)以甲醇为主要原料,电化学合成碳酸二甲酯工作原理如图所示.
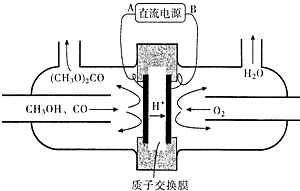
写出阳极的电极反应式2CH3OH+CO-2e-=(CH3O)2CO+2H+.
| A. |  反应的正方向放热(t1时升温) | |
| B. |  SO2气体通入氯水中 | |
| C. |  NaOH溶液滴加Ca(HCO3)2溶液中 | |
| D. |  将PH相同的NH4Cl溶液和稀盐酸稀释时PH的变化 |
| A. | 2:1:1 | B. | 3:2:1 | C. | 3:1:2 | D. | 4:1:3 |
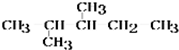
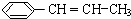 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式:
 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.