题目内容
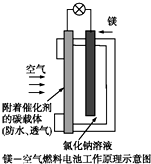 镁燃料电池作为一种高能化学电源,具有良好的应用前景.如图是镁-空气燃料电池工作原理示意图.下列有关该电池的说法正确的是( )
镁燃料电池作为一种高能化学电源,具有良好的应用前景.如图是镁-空气燃料电池工作原理示意图.下列有关该电池的说法正确的是( )| A、该电池Mg作负极,发生还原反应 |
| B、该电池的正极反应式为:O2+2H2O+4e-=4OH- |
| C、电池工作时,电子通过导线由碳电极流向Mg电极 |
| D、当电路中通过0.2 mol电子时,消耗的O2体积为1.12 L |
考点:原电池和电解池的工作原理
专题:
分析:镁燃料电池中,镁的一极为电源的负极,发生氧化反应,通入氧气的一极为原电池的正极,电子由负极经外电路流向正极,由此综合分析.
解答:
解:A、该电池Mg作负极,发生氧化反应,故A错误;
B、该电池的正极反应式为:O2+2H2O+4e-=4OH-,故B正确;
C、电池工作时,电子通过导线由Mg电极流向碳电极,故C错误;
D、状况不知,无法求气体的体积,故D错误;
故选B.
B、该电池的正极反应式为:O2+2H2O+4e-=4OH-,故B正确;
C、电池工作时,电子通过导线由Mg电极流向碳电极,故C错误;
D、状况不知,无法求气体的体积,故D错误;
故选B.
点评:本题考查学生有关燃料电池的工作原理知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
镁、铝和铜的混合物中依次加入过量盐酸、过量烧碱溶液并充分反应后,原混合物中金属的最终存在形式正确的是( )
| A、Mg2+ |
| B、Al3+ |
| C、AlO2- |
| D、Cu(OH)2 |
下列叙述不正确的是( )
| A、电解饱和食盐水时,用铁作阳极,Cl-发生氧化反应 |
| B、电解法精炼铜时,纯铜作阴极,Cu2+发生还原反应 |
| C、电镀铜时,金属铜作阳极,电镀液可用硫酸铜溶液 |
| D、铜锌原电池中,锌作负极,电子从锌极流向铜极 |
用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A、常温常压下,16gCH4中含有5NA个原子 |
| B、1molNa和足量的O2在加热条件下充分反应,转移的电子数为2NA |
| C、1mol/L的Na2CO3溶液中含有2NA个Na+ |
| D、标准状况下,22.4L己烷的分子数为NA |
汽油燃料电池的一极通入空气,另一极通入汽油(以C2H6气体代表汽油);电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在较高温度下能传导O2-.下列对该燃料电池的说法不正确的是( )

| A、多孔电极a是燃料电池的负极 |
| B、生成的水从B口流出,汽油从C口流入 |
| C、在固体电解质中,O2-由正极移向负极 |
| D、通入汽油的一极是负极,电极反应为:C2H6+7O2--14e-═2CO2+3H2O |
下列实验最终能看到白色沉淀的是( )
| A、CO2和SO2气体通入CaCl2溶液 |
| B、过量SO3通入Ba(OH)2溶液 |
| C、过量CO2通入Ba(OH)2溶液 |
| D、过量CO2通入澄清的石灰水 |
下列液体中,滴入水中出现分层现象,滴入热的氢氧化钠溶液中分层现象不会逐渐消失的是(不考虑有机物的挥发)( )
| A、溴乙烷 | B、乙醛 |
| C、橄榄油 | D、汽油 |
下列说法中,错误的是( )
| A、原子半径最小的元素是氢,半径最大的元素是钠 |
| B、单质硅是很好的半导体材料,晶体硅是制造电子元件的重要原料 |
| C、副族元素全都是金属元素 |
| D、稀有气体元素,在一定条件下也可以形成化合物 |
