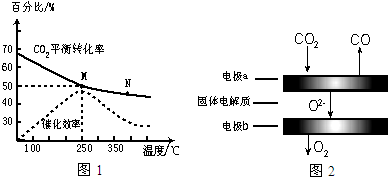
题目内容
11.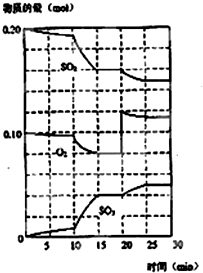 在一定条件下,二氧化硫和氧气发生如图反应:
在一定条件下,二氧化硫和氧气发生如图反应:2SO2(g)+O2 (g)?2SO3(g) (△H<0)
(1)写出该反应的化学平衡常数表达式K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$
(2)降低温度,该反应K值增大,二氧化硫转化率增大(以上均填增大、减小或不变)
(3)据图判断,反应进行至20min时,曲线发生变化的原因是增加了氧气的浓度(或通入氧气)
(4)10min到15min的曲线变化的原因可能是ab(填写编号).
a.加了催化剂 b.缩小容器体积 c.降低温度
d.增加SO3的物质的量.
分析 (1)平衡常数指达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值.
(2)降低温度平衡向放热反应方向移动,根据平衡的移动判断温度对平衡常数、二氧化硫转化率影响,降低温度反应速率减小.
(3)由图可知,反应进行至20min时,改变体积,平衡向正反应移动,瞬间只有氧气的浓度增大.
(4)由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变.
解答 解:(1)可逆反应2SO2(g)+O2 (g)?2SO3(g)的平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$,
故答案为:$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$;
(2)该反应正反应为放热反应,降低温度平衡向正反应方向移动,平衡常数K增大,二氧化硫转化率增大,
故答案为:增大、增大;
(3)由图可知,反应进行至20min时,平衡向正反应移动,瞬间只有氧气的浓度增大,应是增大了氧气的浓度,
故答案为:增加了氧气的浓度(或通入氧气);
(4)由图可知,反应向正反应进行,10min到15min反应混合物单位时间内的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变,
a.加了催化剂,增大反应速率,故a正确;
b.缩小容器体积,增大压强,增大反应速率,故b正确;
c.降低温度反应速率降低,故c错误;
d.10min改变瞬间,各物质的物质的量不变,不是增加SO3的物质的量,故d错误;
故答案为:ab.
点评 本题考查了化学平衡的计算,题目难度中等,涉及化学平衡常数、化学平衡及其影响、化学平衡图象等知识,明确化学平衡及其影响为解答关键,试题培养了学生的分析能力及灵活应用能力.

| A. | 光照射甲烷和氯气的混合气体 | |
| B. | 乙烯通入溴水中 | |
| C. | 在镍作催化剂条件下,苯与氢气反应 | |
| D. | 苯与液溴混合后撒入铁粉 |
| A. | 将lL2mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA | |
| B. | 1L0.1mol/LNaHSO4溶液中含有0.1 Na个HSO4- | |
| C. | 常温常压下,23gNO2和N2O4的混合气体一定含有NA个氧原子 | |
| D. | lmol铁与足量稀盐酸反应转移的电子数目为3NA |
| A. | 10.7 | B. | 8.5 | C. | 32 | D. | 64 |
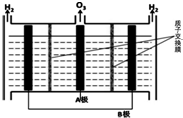 NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:
NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:Ⅰ.利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g)△H=-748kJ/mol
为了测定某催化剂作用下的反应速率,在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生上述反应.用气体传感器测得不同时间NO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
(2)达到平衡时,下列措施能提高NO转化率的是BD.(填字母序号)
A.选用更有效的催化剂
B.降低反应体系的温度
C.充入氩气使容器内压强增大
D.充入CO使容器内压强增大
(3)已知N2(g)+O2(g)=2NO(g)△H=+180kJ/mol;则CO的燃烧热为284 kJ/mol.
Ⅱ.臭氧也可用于处理NO.
(4)O3氧化NO结合水洗可产生HNO3和O2,每生成1mol的HNO3转移3mol电子.
(5)O3可由电解稀硫酸制得,原理如图.图中阴极为B(填“A”或“B”),阳极(惰性电极)的电极反应式为3H2O-6e-=O3+6H+.
| A. | 通过质谱法只能确认化合物的相对分子质量,一般无法确定其结构 | |
| B. | 甲苯分子的核磁共振氢谱中有2个不同的吸收峰 | |
| C. | 红外光谱可以帮助确定许多有机物结构 | |
| D. | 某有机物完全燃烧只生成CO2和H2O,两者的物质的量之比为1:2,则该有机物可能为甲烷或甲醇 |
| A. | c(Na+)=c(HS-)+2c(S2-)+c(OH-) | |
| B. | c(H2S)+c(HS-)+c(S2-)=0.1 mol/L | |
| C. | 将上述溶液稀释至0.01 mol/L,c(H+)•c(OH-)不变 | |
| D. | c(S2-)+c(OH-)=c(H+)+c(H2S) |
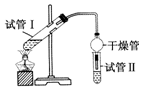 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O(1)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}COO{C}_{2}{H}_{5})}{c(C{H}_{3}COOH)c({C}_{2}{H}_{5}OH)}$.
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如表:
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol•L-1浓H2SO4 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
②分析实验A(填实验编号)的数据,可以推测出浓H2SO4的吸水性,提高了乙酸乙酯的产率.浓H2SO4的吸水性能够提高乙酸乙酯产率的原因是浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动.
③加热有利于提高乙酯乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是乙酸、乙醇都易挥发,温度过高可能使乙酸、乙醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.