题目内容
1. 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室制备乙酸乙酯的化学方程式如下:CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O(1)该反应的平衡常数表达式K=$\frac{c(C{H}_{3}COO{C}_{2}{H}_{5})}{c(C{H}_{3}COOH)c({C}_{2}{H}_{5}OH)}$.
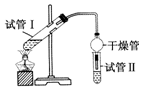
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如表:
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL 18mol•L-1浓H2SO4 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
②分析实验A(填实验编号)的数据,可以推测出浓H2SO4的吸水性,提高了乙酸乙酯的产率.浓H2SO4的吸水性能够提高乙酸乙酯产率的原因是浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动.
③加热有利于提高乙酯乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是乙酸、乙醇都易挥发,温度过高可能使乙酸、乙醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
分析 (1)根据平衡常数的定义判断,为反应物与生成物的浓度幂之积的比值,注意水为纯液体;
(2)①对比试验关键是要采用控制变量,即控制一个变量,其它条件不变,所以可以从控制变量的角度来分析解答;
②根据实验A和实验B的数据进行解答;水在酯化反应中为生成物,从生成物对化学平衡的影响角度分析;
③乙酸和乙醇容易挥发,且温度过高容易发生副反应.
解答 解:(1)水为纯液体,则CH3COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H2O的平衡常数表达式为K=$\frac{c(C{H}_{3}COO{C}_{2}{H}_{5})}{c(C{H}_{3}COOH)c({C}_{2}{H}_{5}OH)}$,
故答案为:$\frac{c(C{H}_{3}COO{C}_{2}{H}_{5})}{c(C{H}_{3}COOH)c({C}_{2}{H}_{5}OH)}$;
(2)①本题是研究实验D与实验C相对照,证明H+对酯化反应具有催化作用的条件,题中采用了一个变量,实验C3mol•L-1 H2SO4,实验D盐酸,所以达到实验目的,实验D与实验C中H+的浓度一样,实验C3mL乙醇、2mL乙酸、3mol•L-1 H2SO4,实验D3mL乙醇、2mL乙酸、盐酸,要保证溶液体积一致,才能保证乙醇、乙酸的浓度不变,盐酸体积为6mL,实验D与实验C中H+的浓度一样,所以盐酸的浓度为6mol•L-1,
故答案为:6,6;
②对照实验A和B可知:试管Ⅰ中试剂实验A比实验B多1mL18mol•L-1 浓硫酸,但是试管Ⅱ中试剂中测得有机层乙酸乙酯的厚度,实验A为5.0cm,而实验B只有0.1cm,说明浓硫酸的吸水性提高了乙酸乙酯的产率;酯化反应为可逆反应,浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动,
故答案为:A;浓硫酸吸收酯化反应生成的水,降低了生成物浓度,使平衡向生成乙酸乙酯方向移动;
③乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,实验发现温度过高,乙酸乙酯的产率反而降低,是由于乙酸、乙醇都易挥发,使产率降低,或因温度过高可能发生副反应使产率降低,如乙醇在140℃,在浓硫酸催化下脱水生成乙醚,
故答案为:乙酸、乙醇都易挥发,温度过高可能使乙酸、乙醇大量挥发使产率降低,温度过高可能发生副反应使产率降低.
点评 本题考查了乙酸乙酯的制备方法,为高频考点,题目还涉及温度对反应速率、化学平衡的影响等知识,题目难度中等,注意把握乙酸乙酯的制备原理和实验方法,明确影响反应速率、化学平衡的因素.

| 实 验 事 实 | 结 论 | |
| ① | SO2使酸性高锰酸钾溶液褪色 | 可证明SO2有漂白性 |
| ② | 浓盐酸可除去烧瓶内残留的MnO2,稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶不能保存NaOH溶液 | 都发生了氧化还原反应 |
| ③ | 取少量Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀,滴加稀盐酸,沉淀不溶解 | 证明Na2SO3已氧化变质 |
| ④ | 某溶液只含一种溶质,加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,向该溶液中滴加BaCl2溶液,有白色沉淀生成 | 确定该溶液中存在CO32- |
| ⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润蓝色石蕊试纸变红 | 该溶液一定有NH4+ |
| A. | ①②④⑤ | B. | ①②③⑤ | C. | ①③④⑤ | D. | 全部 |
| A. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后得到NH3分子数为NA | |
| B. | 一定条件下,2.3g的Na完全与O2反应生成3.5g产物时失去的电子数为0.1NA | |
| C. | 1.0L的0.1 mol•L-1Na2CO3溶液中含有的CO32-离子数为0.1NA | |
| D. | 标准状况下,11.2L的CCl4中含有的CCl4分子数为0.5NA |
| A. | 质量数为94 | B. | 中子数为144 | C. | 质子数为238 | D. | 电子数为144 |
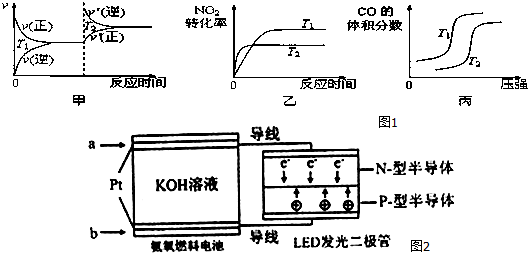
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.
4CO(g)+2NO2(g)?4CO2(g)+N2(g)△H=-1200kJ•mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,如图1图象正确的是乙(填代号).
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H在T1℃时,反应进行到不同时间测得各物质的量浓度如表:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是bc(填字母代号).
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率降低(填“升高”或“降低”),△H<0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2].已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-87.0 kJ•mol-1.
(4)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液.
电池反应为:4NH3+3O2=2N2+6H2O;
请写出通入图2中a气体一极的电极反应式为2NH3+6OH--6e-=N2+6H2O;每消耗3.4g NH3转移电子的物质的量为0.6mol.
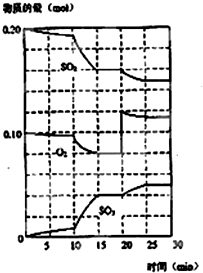 在一定条件下,二氧化硫和氧气发生如图反应:
在一定条件下,二氧化硫和氧气发生如图反应: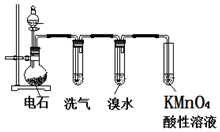 如图为实验室制取乙炔并验证其性质的装置图,回答下列问题:
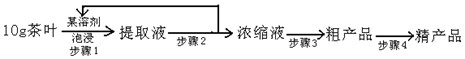
如图为实验室制取乙炔并验证其性质的装置图,回答下列问题: ,实验室可通过下列简单方法从茶叶中提取咖啡因:
,实验室可通过下列简单方法从茶叶中提取咖啡因: