题目内容
13.加热N2O5,依次发生的分解反应为①N2O5(g)?N2O3(g)+O2(g),②N2O3(g)?N2O(g)+O2(g);在2L密闭容器中充入6mol N2O5,加热到t℃,达到平衡状态后O2为8mol,N2O3为3.2mol.则t℃时反应①的平衡常数为( )| A. | 10.7 | B. | 8.5 | C. | 32 | D. | 64 |
分析 利用化学平衡常数公式可知,需要求N2O5、N2O3、O2浓度,N2O3、O2浓度好求,关键求N2O5的浓度,设分解的N2O3物质的量为x,反应过程中共生成N2O3(x+3.2)mol,则N2O5分解了(x+3.2)mol,再利用氧气总量8mol,求出x进一步求算.
解答 解:设分解的N2O3物质的量为x,反应过程中共生成N2O3(x+3.2)mol,在①反应中N2O5分解了(x+3.2)mol,同时生成O2(x+3.2)mol.在②反应中生成氧气xmol.
则(x+3.2)+x=8,
求得x=2.4
所以平衡后N2O5、N2O3、O2浓度依次为
c(N2O5)=$\frac{6-2.4-3.2}{2}$=0.2molL-1
c(N2O3)=$\frac{3.2}{2}$=1.6molL-1
c(O2)=$\frac{8}{2}$=4molL-1
反应①的平衡常数
K=$\frac{1.6×4}{0.2}$=32,
故选:C.
点评 本题是一个求算化学平衡常数的题目,注意化学平衡常数的计算难点在于利用氧气求算时在第一个方程式中有一部分氧气被漏掉从而错误.

练习册系列答案
相关题目
3.将1mol SO2和1mol O2通入密闭容器中,在一定条件下反应达到平衡,平衡体系中有SO3 0.3mol,此时若移走0.5mol O2和0.5mol SO2,则反应达到新平衡时SO3的物质的量为( )
| A. | 0.3mol | B. | 0.15mol | ||
| C. | 小于0.15mol | D. | 大于0.15mol,小于0.3mol |
4.等物质的量的CH4、C2H4、C2H2,分别在足量O2中完全燃烧,以下说法正确的是( )
| A. | C2H2含碳量最高,燃烧生成的CO2最多 | |
| B. | C2H2燃烧时火焰最明亮 | |
| C. | CH4含氢量最高,燃烧生成H2O最多 | |
| D. | CH4、C2H4燃烧生成H2O质量不同,消耗O2不同 |
1.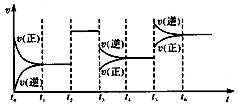 某密闭容器中发生反应:X(g)+3Y(g)?2Z(g)△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
某密闭容器中发生反应:X(g)+3Y(g)?2Z(g)△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
 某密闭容器中发生反应:X(g)+3Y(g)?2Z(g)△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
某密闭容器中发生反应:X(g)+3Y(g)?2Z(g)△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )| A. | t2时加入了催化剂 | |
| B. | t3时平衡的移动可使化学平衡常数减小 | |
| C. | t5时增大了压强 | |
| D. | t6时达到平衡后反应物的转化率最大 |
8.0.01mol氯化铬(CrCl3•6H2O)在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.已知Cr3+的配位数为6,则此氯化铬化学式是( )
| A. | [Cr(H2O)6]Cl3 | B. | [Cr(H2O)5Cl]Cl2•H2O | ||
| C. | [Cr(H2O)4Cl2]Cl•2H2O | D. | [Cr(H2O)3Cl3]•3H2O |
4. CO2和CH4均为温室气体,研究它们具有重要的意义.
CO2和CH4均为温室气体,研究它们具有重要的意义.
(1)已知CH4、H2、CO的燃烧热△H分别为-890.3kJ/mol、-285.8kJ/mol、-283.0kJ/mol则CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.3kJ/mol.
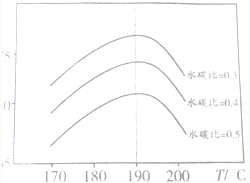
(2)以CO2和NH3为原料合成尿素是研究CO2的成功范例.在尿素合成塔中反应如下:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H=-86.98kJ/mol反应中影响CO2平衡转化率的因素很多,如图为特定条件下,不同水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$和温度对CO2平衡转化率的影响曲线.
①为提高CO2的转化率,生产中除控制温度外,还可采取的措施有增大压强、降低水碳比
②当温度高于190℃,CO2平衡转化率出现如图所示的变化趋势,其原因是温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低
(3)向1.0L的密闭容器中通入0.2mol NH3和0.1mol CO2,在一定的温度下,发生反应2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g),反应时间与气体总压强p的数据如下表:
用起始压强和总压强计算平衡时NH3 的转化率为80%,0-80min内CO2的平均反应速率是0.001mol/(L•min).
(4)氨基甲酸铵NH2COONH4极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.此时溶液中c(NH4+)=0.1mol/L;NH4+水解平衡常数值为4×10-9.
 CO2和CH4均为温室气体,研究它们具有重要的意义.
CO2和CH4均为温室气体,研究它们具有重要的意义.(1)已知CH4、H2、CO的燃烧热△H分别为-890.3kJ/mol、-285.8kJ/mol、-283.0kJ/mol则CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.3kJ/mol.
(2)以CO2和NH3为原料合成尿素是研究CO2的成功范例.在尿素合成塔中反应如下:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H=-86.98kJ/mol反应中影响CO2平衡转化率的因素很多,如图为特定条件下,不同水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$和温度对CO2平衡转化率的影响曲线.
①为提高CO2的转化率,生产中除控制温度外,还可采取的措施有增大压强、降低水碳比
②当温度高于190℃,CO2平衡转化率出现如图所示的变化趋势,其原因是温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低
(3)向1.0L的密闭容器中通入0.2mol NH3和0.1mol CO2,在一定的温度下,发生反应2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g),反应时间与气体总压强p的数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 65 | 80 | 100 |
| 总压强p/100kPa | 9.53 | 7.85 | 6.37 | 5.78 | 5.24 | 4.93 | 4.67 | 4.45 | 4.45 |
(4)氨基甲酸铵NH2COONH4极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.此时溶液中c(NH4+)=0.1mol/L;NH4+水解平衡常数值为4×10-9.
9.NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后得到NH3分子数为NA | |
| B. | 一定条件下,2.3g的Na完全与O2反应生成3.5g产物时失去的电子数为0.1NA | |
| C. | 1.0L的0.1 mol•L-1Na2CO3溶液中含有的CO32-离子数为0.1NA | |
| D. | 标准状况下,11.2L的CCl4中含有的CCl4分子数为0.5NA |
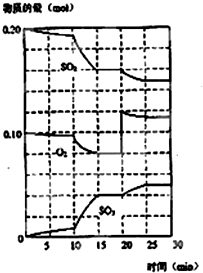 在一定条件下,二氧化硫和氧气发生如图反应:
在一定条件下,二氧化硫和氧气发生如图反应: