题目内容
1.已知4A(s)+5B(g)?4C(g)+6D(g)△H<0 在一密闭容器中反应的v-t图.t1时,改变了一个条件,下列叙述正确的是( )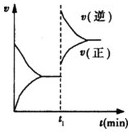
| A. | t1时,一定是缩小了容器的体积 | |
| B. | t1时,可能是向容器中通入了一定量的C气体 | |
| C. | t1时改变外界条件后,该反应的平衡常数可能减小,也可能不变 | |
| D. | t1时,可能是向容器中加入了催化剂 |
分析 该反应是一个反应前后气体物质的量之和增大的放热反应,根据图知,t1时,改变了一个条件,正逆反应速率都增大且逆反应速率增大倍数大于正反应速率,平衡向逆反应方向移动,应该是增大压强或升高温度,据此分析解答.
解答 解:该反应是一个反应前后气体物质的量之和增大的放热反应,根据图知,t1时,改变了一个条件,正逆反应速率都增大且逆反应速率增大倍数大于正反应速率,平衡向逆反应方向移动,应该是增大压强或升高温度,
A.根据以上分析知,t1时,可能是缩小了容器的体积或.升高温度,故A错误;
B.t1时,如果是向容器中通入了一定量的C气体,在改变条件瞬间,逆反应速率增大而正反应速率不变,不符合图象,故B错误;
C.如果是升高温度,改变条件时化学平衡常数减小,如果是增大压强,化学平衡常数不变,故C正确;
D.如果改变的条件是加入催化剂,正逆反应速率都增大但仍然相等,不符合图象,故D错误;
故选C.
点评 本题考查v-t图象分析,为高频考点,侧重考查学生分析判断能力,明确温度、压强、浓度v-t图象曲线变化趋势是解本题关键,根据条件改变时正逆反应速率相对大小确定平衡移动方向,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.己知1L 0.1mol/L的NaRO3溶液中含RO3-的质量为8.5g.在RO3-中,氧原子中质子数和中子数相等,R的中子数为20,则RO3-的核外电子总数为( )
| A. | 41 | B. | 42 | C. | 44 | D. | 46 |
12.下列有关实验原理、方法和结论都正确的是( )
| A. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 | |
| B. | 取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 用渗析法除去淀粉中混有的NaCl | |
| D. | 已知${I}_{3}^{-}$?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
9.下列说法不正确的是( )
| A. | 0.2mol/L的NaHCO3溶液中:[Na+]>[HCO3-]>[OH-]>[H+] | |
| B. | 在0.1mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) | |
| C. | 向氨水中逐滴加入盐酸至溶液的pH=7,则混合液中:[NH4+]=[Cl-] | |
| D. | pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 |
16.用0.1mol•L-1 NaOH溶液分别滴定体积均为20mL浓度均为0.1mol•L-1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化曲线如图所示,下列有关说法中正确的是( )

| A. | HX为弱酸,且电离平衡常数Ka≈1×10-10 | |
| B. | 水的电离程度:M点大于N点 | |
| C. | P点c(Cl-)=0.05mol•L-1. | |
| D. | M点c(HX)-c(X-)>c(OH-)-c(H+) |
6.对于反应4A(s)+3B(g)?2C(g)+D(g)已达到平衡的是( )
| A. | 单位时间内消耗amolD,同时生成2amolC | |
| B. | 3v(B)正=2v(C)逆 | |
| C. | 容器内的压强不再变化 | |
| D. | C(B);C(C);C(D)=3;2;1 |
12.我国稀土资源丰富.下列有关稀土元素${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的说法正确的是( )
| A. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm互为同位素 | |
| B. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的质量数相同 | |
| C. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm是同一种核素 | |
| D. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm是不同元素 |