题目内容
9.下列说法不正确的是( )| A. | 0.2mol/L的NaHCO3溶液中:[Na+]>[HCO3-]>[OH-]>[H+] | |
| B. | 在0.1mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) | |
| C. | 向氨水中逐滴加入盐酸至溶液的pH=7,则混合液中:[NH4+]=[Cl-] | |
| D. | pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 |
分析 A、HCO3-在溶液中既能电离又能水解,且水解大于电离;
B、在醋酸钠溶液中,所有的氢离子和氢氧根均来自于水的电离,且水电离出的氢离子和氢氧根的浓度相等;
C、氨水和盐酸混合后pH=7,即有[OH-]=[H+],根据电荷守恒来分析;
D、pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后,醋酸过量.
解答 解:A、HCO3-在溶液中既能电离又能水解,且水解大于电离,故溶液显碱性[OH-]>[H+],且[Na+]>[HCO3-],故有[Na+]>[HCO3-]>[OH-]>[H+],故A正确;
B、在醋酸钠溶液中,所有的氢离子和氢氧根均来自于水的电离,且水电离出的氢离子和氢氧根的浓度相等,根据质子守恒可知:c(OH-)=c(CH3COOH)+c(H+),故B正确;
C、氨水和盐酸混合后pH=7,即有[OH-]=[H+],根据电荷守恒可知:[OH-]+[Cl-]=[H+]+[NH4+],故有[Cl-]=[NH4+],故C正确;
D、pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后,醋酸过量,故所得溶液为醋酸和醋酸钠的混合物,溶液显酸性,pH<7,故D错误.
故选D.
点评 本题考查了酸碱混合后溶液中离子浓度的大小比较以及三个守恒的运用,应注意的是水电离出的氢离子和氢氧根的浓度永远相等.

练习册系列答案
相关题目
19.下列说法正确的是( )
| A. | 贝采里乌斯打破了无机物和有机物的界限 | |
| B. | 苯丙氨酸可以与NaOH溶液或HCl溶液反应形成内盐,内盐的形成是由氢键所致 | |
| C. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| D. | 李比希法、钠融法、铜丝燃烧法、元素分析仪均可帮助人们确定有机化合物的元素组成和空间结构 |
20.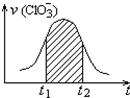 氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3-在单位时间内的物质的量浓度的变化来表示该反应速率的速率-时间图象.下列说法不正确的是( )
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3-在单位时间内的物质的量浓度的变化来表示该反应速率的速率-时间图象.下列说法不正确的是( )
 氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3-在单位时间内的物质的量浓度的变化来表示该反应速率的速率-时间图象.下列说法不正确的是( )
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3-在单位时间内的物质的量浓度的变化来表示该反应速率的速率-时间图象.下列说法不正确的是( )| A. | 反应开始时速率增大可能是c(H+)增大引起的 | |
| B. | 纵坐标为v(H+)的速率-时间曲线与图中曲线不能完全重合 | |
| C. | 后期反应速率下降的主要原因是反应物浓度减小 | |
| D. | 图中阴影部分“面积”为t1至t2时间内的ClO3-的物质的量的减小值 |
1.已知4A(s)+5B(g)?4C(g)+6D(g)△H<0 在一密闭容器中反应的v-t图.t1时,改变了一个条件,下列叙述正确的是( )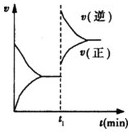

| A. | t1时,一定是缩小了容器的体积 | |
| B. | t1时,可能是向容器中通入了一定量的C气体 | |
| C. | t1时改变外界条件后,该反应的平衡常数可能减小,也可能不变 | |
| D. | t1时,可能是向容器中加入了催化剂 |
20.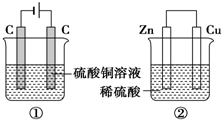 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )
 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 电极反应式:①中阴极:Cu2++2e-═Cu②中正极:2H++2e-═H2↑ | |
| D. | 反应完成后溶液PH:①<7,②>7 |
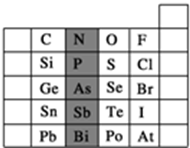 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.