题目内容
11.己知1L 0.1mol/L的NaRO3溶液中含RO3-的质量为8.5g.在RO3-中,氧原子中质子数和中子数相等,R的中子数为20,则RO3-的核外电子总数为( )| A. | 41 | B. | 42 | C. | 44 | D. | 46 |
分析 先计算RO3-的物质的量,再计算RO3-的摩尔质量,计算出R的相对原子质量,根据质子数=质量数-中子数,阴离子核外电子数=质子数+所带电荷数解题.
解答 解:RO3-的物质的量为:0.1mol/L×1L=0.1mol,RO3-的摩尔质量为:$\frac{8.5g}{0.1mol}$=85g/mol,故RO3-的相对离子质量为85,R的相对原子质量为:85-16×3=37,R的质子数为:37-20=17,故RO3-的核外电子总数为:17+8×3+1=42,
故选B.
点评 本题主要考查了中子数、质量数、质子数之间的关系,明确离子核外电子数、质子数、电荷数之间的关系是解题的关键,难度不大.

练习册系列答案
相关题目
1.已知:①2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol
下列说法中错误的是( )
②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol
下列说法中错误的是( )
| A. | ①式表示常温常压时,2 mol H2和1 mol O2完全燃烧生成2 mol H2O(l)放热571.6 kJ | |
| B. | 2H2(g)+O2(g)=2H2O(g)中△H大于-571.6 kJ•mol-1 | |
| C. | 将含1 mol NaOH的水溶液与50 g 98%的硫酸溶液混合后放出的热量大于57.3 kJ | |
| D. | 将含1 mol NaOH的稀溶液与含1 mol CH3COOH的稀溶液混合后放出的热量为57.3 kJ |
2.BF3与一定量的水形成晶体Q[(H2O)2•BF3],Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力不涉及( )
①离子键 ②共价键 ③配位键 ④金属键 ⑤氢键 ⑥范德华力.

晶体Q中各种微粒间的作用力不涉及( )
①离子键 ②共价键 ③配位键 ④金属键 ⑤氢键 ⑥范德华力.
| A. | ①⑤ | B. | ②⑥ | C. | ①④ | D. | ①④⑥ |
19.下列说法正确的是( )
| A. | 贝采里乌斯打破了无机物和有机物的界限 | |
| B. | 苯丙氨酸可以与NaOH溶液或HCl溶液反应形成内盐,内盐的形成是由氢键所致 | |
| C. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| D. | 李比希法、钠融法、铜丝燃烧法、元素分析仪均可帮助人们确定有机化合物的元素组成和空间结构 |
6.若将12.8g铜跟一定量的浓硝酸反应,铜耗完时,共产生5.6L (己换算成标准状况)NO和NO2的混合气体,则所消耗硝酸的物质的量是( )
| A. | 0.25mol | B. | 0.2mol | C. | 0.45mol | D. | 0.65mol |
3.下列措施对增大反应速率明显有效的是( )
| A. | 钾与水反应时增大水的用量 | |
| B. | 铝与稀硫酸反应制取氢气时,改用浓硫酸 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| D. | 实验室制取二氧化碳时,将块状大理石改为粉状大理石 |
20.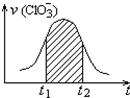 氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3-在单位时间内的物质的量浓度的变化来表示该反应速率的速率-时间图象.下列说法不正确的是( )
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3-在单位时间内的物质的量浓度的变化来表示该反应速率的速率-时间图象.下列说法不正确的是( )
 氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3-在单位时间内的物质的量浓度的变化来表示该反应速率的速率-时间图象.下列说法不正确的是( )
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3-在单位时间内的物质的量浓度的变化来表示该反应速率的速率-时间图象.下列说法不正确的是( )| A. | 反应开始时速率增大可能是c(H+)增大引起的 | |
| B. | 纵坐标为v(H+)的速率-时间曲线与图中曲线不能完全重合 | |
| C. | 后期反应速率下降的主要原因是反应物浓度减小 | |
| D. | 图中阴影部分“面积”为t1至t2时间内的ClO3-的物质的量的减小值 |
1.已知4A(s)+5B(g)?4C(g)+6D(g)△H<0 在一密闭容器中反应的v-t图.t1时,改变了一个条件,下列叙述正确的是( )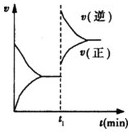

| A. | t1时,一定是缩小了容器的体积 | |
| B. | t1时,可能是向容器中通入了一定量的C气体 | |
| C. | t1时改变外界条件后,该反应的平衡常数可能减小,也可能不变 | |
| D. | t1时,可能是向容器中加入了催化剂 |