题目内容
9.(1)工业上用电石-乙炔生产氯乙烯的反应如下:CaO+3C$\stackrel{2200℃-2300℃}{→}$CaC2+CO
CaC2+2H2O→CH≡CH+Ca(OH)2
CH≡CH+HCl$→_{140℃-200℃}^{HgCl_{2}}$CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖与石油资源.
电石-乙炔法的缺点是:反应温度高,能耗大、使用的催化剂毒性大.
分析 通过反应的条件(温度、催化剂)分析电石-乙炔法的缺点.
解答 解:CaO+3C$\stackrel{2200℃-2300℃}{→}$CaC2+CO,反应温度高,能耗大,CH≡CH+HCl$→_{140℃-200℃}^{HgCl_{2}}$CH2=CHCl,使用HgCl2做催化剂,毒性大,
故答案为:反应温度高,能耗大;使用的催化剂毒性大.
点评 本题为2014年上海考题,侧重于实验方案的分析与评价,题目难度不大,注意把握实验的原理以及题给信息.

练习册系列答案
相关题目
19.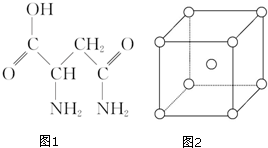 芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
(1)天冬酰胺所含元素中,氮(填元素名称)元素基态原子核外未成对电子数最多,第一电离能最大的是氮.
(2)天冬酰胺中碳原子的杂化轨道类型为sp3和sp2,分子中σ和π键数目之比为8:1.
(3)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表.
H2S的键角大于H2Se的原因可能为由于硫的电负性强于Se,形成的共用电子对斥力大,键角大.H2O、H2S、H2Se沸点由高到低的顺序为H2O>H2Se>H2S,酸性由强到弱的顺序为H2Se>H2S>H2O.
(4)写出铬的基态电子排布式:1s22s22p63s23p63d54s1或[Ar]3d54s1.
(5)金属铬为体心立方晶体,晶胞结构如图2,则该晶胞中含有2个铬原子.若铬的密度为ρg•
cm-3,相对原子质量为M,NA表示阿伏加德罗常数的值,则铬原子的半径为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{{N}_{A}ρ}}$cm.
 芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.(1)天冬酰胺所含元素中,氮(填元素名称)元素基态原子核外未成对电子数最多,第一电离能最大的是氮.
(2)天冬酰胺中碳原子的杂化轨道类型为sp3和sp2,分子中σ和π键数目之比为8:1.
(3)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表.
| 化学式 | 键长/nm | 键角 |
| H2O | 0.99 | 104.5° |
| H2S | 1.34 | 92.3° |
| H2Se | 1.47 | 91.0° |
(4)写出铬的基态电子排布式:1s22s22p63s23p63d54s1或[Ar]3d54s1.
(5)金属铬为体心立方晶体,晶胞结构如图2,则该晶胞中含有2个铬原子.若铬的密度为ρg•
cm-3,相对原子质量为M,NA表示阿伏加德罗常数的值,则铬原子的半径为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{{N}_{A}ρ}}$cm.
20.下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在这些元素中最活泼的非金属元素是F
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH
(3)呈两性的氢氧化物是Al(OH)3,其与③的最高价氧化物水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O
(4)在③~⑦元素中,原子半径最大的是Na
(5)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH
(3)呈两性的氢氧化物是Al(OH)3,其与③的最高价氧化物水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O
(4)在③~⑦元素中,原子半径最大的是Na
(5)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
14.下列是卤素单质(F2、Cl2、Br2、I2)的沸点与相对分子质量的关系图,下列说法错误的是( )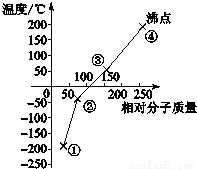

| A. | 单质①是最活泼的非金属单质 | |
| B. | 单质②能使品红溶液褪色 | |
| C. | 保存少量的单质③时加少量水进行水封 | |
| D. | 单质④的氢化物在卤素氢化物中沸点最高 |
18.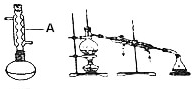 苯佐卡因(对氨基甲酸乙酯)常用于创面、溃疡面及痔疮的止痛,也是镇咳药退咳药的中间体,有关数据和实验装置图如下:
苯佐卡因(对氨基甲酸乙酯)常用于创面、溃疡面及痔疮的止痛,也是镇咳药退咳药的中间体,有关数据和实验装置图如下:
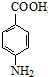 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$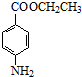 +H2O.
+H2O.
合成反应:
在圆底烧瓶中加入0.4g(0.0029mol)对氨基苯甲酸和0.082mol乙醇,振荡溶解,将烧瓶置于冰水浴并加入0.22mL浓硫酸(0.004mol),将反应混合物在水浴上加热回流1h,并不时振荡.
分离提纯:
冷却后,分批加入10%的NaHCO3溶液直至无明显气泡产生,再加少量NaCHO3溶液至pH≈9,转移至分液漏斗中,用乙醚分两次萃取,并向乙醚层加入无水硫酸钠,得到乙醚层,冷却结晶,最终得到产物0.2g.
(1)仪器A的名称:球形冷凝管,烧瓶置于水浴中的原因反应温度低于水的沸点,受热均匀,偏于控制温度,.
(2)加热前还需在烧瓶中加入碎瓷片.
(3)在合成反应中,圆底烧瓶的容积最合适的是A
A.10mL B.20mL C.50mL
(4)分液漏斗使用前必须进行的操作是查漏,乙醚层位于上层(填“上层”或“下层”);分离提纯操作加入无水硫酸钠的作用是吸收乙醚中的水.
(5)合成反应中加入过量乙醇的目的是提高对氨基苯甲酸的利用率;分离提纯过程中10%NaHCO3溶液的作用是除去混有对氨基苯甲酸.
(6)本实验中苯佐卡因的产率为41.8%(结果保留三位有效数字)
 苯佐卡因(对氨基甲酸乙酯)常用于创面、溃疡面及痔疮的止痛,也是镇咳药退咳药的中间体,有关数据和实验装置图如下:
苯佐卡因(对氨基甲酸乙酯)常用于创面、溃疡面及痔疮的止痛,也是镇咳药退咳药的中间体,有关数据和实验装置图如下: +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$ +H2O.
+H2O.| 相对分子质量 | 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | 水中溶解性 | |
| 乙醇 | 46 | 0.789 | -117.3 | 78.5 | 与水任意比互溶 |
| 对氨基苯甲酸 | 137 | 1.374 | 188 | 339.9 | 微溶于水 |
| 对氨基苯甲酸乙酯 | 165 | 1.039 | 90 | 172 | 难溶于水,易溶于醇、醛类 |
在圆底烧瓶中加入0.4g(0.0029mol)对氨基苯甲酸和0.082mol乙醇,振荡溶解,将烧瓶置于冰水浴并加入0.22mL浓硫酸(0.004mol),将反应混合物在水浴上加热回流1h,并不时振荡.
分离提纯:
冷却后,分批加入10%的NaHCO3溶液直至无明显气泡产生,再加少量NaCHO3溶液至pH≈9,转移至分液漏斗中,用乙醚分两次萃取,并向乙醚层加入无水硫酸钠,得到乙醚层,冷却结晶,最终得到产物0.2g.
(1)仪器A的名称:球形冷凝管,烧瓶置于水浴中的原因反应温度低于水的沸点,受热均匀,偏于控制温度,.
(2)加热前还需在烧瓶中加入碎瓷片.
(3)在合成反应中,圆底烧瓶的容积最合适的是A
A.10mL B.20mL C.50mL
(4)分液漏斗使用前必须进行的操作是查漏,乙醚层位于上层(填“上层”或“下层”);分离提纯操作加入无水硫酸钠的作用是吸收乙醚中的水.
(5)合成反应中加入过量乙醇的目的是提高对氨基苯甲酸的利用率;分离提纯过程中10%NaHCO3溶液的作用是除去混有对氨基苯甲酸.
(6)本实验中苯佐卡因的产率为41.8%(结果保留三位有效数字)
9.对将待测液置于锥形瓶的滴定实验,下列错误操作中,能造成中和滴定结果偏低的是( )
| A. | 未用标准液润洗滴定管 | |
| B. | 盛标准液的滴定管尖嘴部分有气泡未排除就开始滴定 | |
| C. | 往锥形瓶中加待测液时,锥形瓶中有少许水 | |
| D. | 振荡时锥形瓶中液滴飞溅出来 |
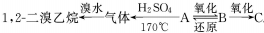 ,其中B可发生银镜反应,C跟石灰石反应产生能使石灰水变浑浊的气体;
,其中B可发生银镜反应,C跟石灰石反应产生能使石灰水变浑浊的气体;