题目内容
1.有A、B、C三种烃的衍生物,相互转化关系如下: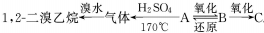 ,其中B可发生银镜反应,C跟石灰石反应产生能使石灰水变浑浊的气体;
,其中B可发生银镜反应,C跟石灰石反应产生能使石灰水变浑浊的气体;(1)推断A、B、C的结构简式依次是CH3CH2OH、CH3CHO、CH3COOH;
(2)生成A气体的反应类型为消去反应; 化学方程式为CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O.
分析 气体和溴水反应生成1,2-二溴乙烷,则该气体为CH2=CH2,则A应为CH3CH2OH,B可发生银镜反应,B发生还原反应得到乙醇,则B为CH3CHO,C跟石灰石反应产生使石灰水变浑浊的气体,且乙醛发生氧化反应生成C,则C为CH3COOH,以此来解答.
解答 解:气体和溴水反应生成1,2-二溴乙烷,则该气体为CH2=CH2,则A应为CH3CH2OH,B可发生银镜反应,B发生还原反应得到乙醇,则B为CH3CHO,C跟石灰石反应产生使石灰水变浑浊的气体,且乙醛发生氧化反应生成C,则C为CH3COOH,
(1)由上述分析可知,A、B、C分别为CH3CH2OH、CH3CHO、CH3COOH,故答案为:CH3CH2OH;CH3CHO;CH3COOH;
(2)生成乙烯的反应为CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,属于消去反应,故答案为:消去反应;CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O.
点评 本题考查有机物的推断,为高频考点,把握有机反应中官能团的变化、官能团与性质的关系等为解答的关键,侧重分析与推断能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验).
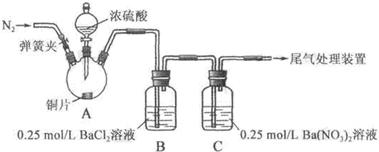
实验操作和现象:
(1)A中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)C中白色沉淀是BaSO4,该沉淀的生成表明SO2具有还原性.
(3)C中液面上方生成浅棕色气体的化学方程式是2NO+O2═2NO2.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是通N2一段时间,排除装置中的空气;乙在A、B间增加洗气瓶D,D中盛放的试剂是饱和NaHSO3溶液.
②进行实验,B中现象:
(5)合并(4)中两同学的方案进行实验.B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀.

实验操作和现象:
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(2)C中白色沉淀是BaSO4,该沉淀的生成表明SO2具有还原性.
(3)C中液面上方生成浅棕色气体的化学方程式是2NO+O2═2NO2.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是通N2一段时间,排除装置中的空气;乙在A、B间增加洗气瓶D,D中盛放的试剂是饱和NaHSO3溶液.
②进行实验,B中现象:
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
12.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 0.1mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA | |
| B. | 1mol镁与足量O2或N2反应生成MgO或Mg3N2失去电子分别为2NA和3NA | |
| C. | 含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 某密闭容器中盛有0.2molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6 NA |
16.下列各组物质所含化学键类型完全相同的是( )
| A. | HNO3和NH4NO3 | B. | NaOH和KCl | C. | NaN3和CaO2 | D. | AlCl3和MgCl2 |
6.能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一.
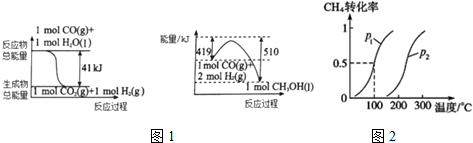
(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图1:则CO2与H2反应生成液态CH3OH的热化学方程式为CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol.
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH:
I.CH4(g)+H2O(g)?CO(g)+3H2(g);△H1>0
Ⅱ.CO(g)+2H2(g)?CH3OH(g);△H2<0
将1.0molCH4和3.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如图2所示.
①图中的p1<p2(填“<”、“>”或“=”),判断的理由是该反应正方向为体积增大的方向,相同温度下,压强越大甲烷的转化率减小,P2 的转化率比P1小,说明P2<P1.
②若反应Ⅱ在恒容密闭容器进行,下列能判断反应Ⅱ达到平衡状态的是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的总物质的量不变 d.CH3OH、CO、H2的浓度都不再发生变化
③在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
若5min时只改变了某一条件,则所改变的条件是加了1mol氢气.

(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图1:则CO2与H2反应生成液态CH3OH的热化学方程式为CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol.
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH:
I.CH4(g)+H2O(g)?CO(g)+3H2(g);△H1>0
Ⅱ.CO(g)+2H2(g)?CH3OH(g);△H2<0
将1.0molCH4和3.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如图2所示.
①图中的p1<p2(填“<”、“>”或“=”),判断的理由是该反应正方向为体积增大的方向,相同温度下,压强越大甲烷的转化率减小,P2 的转化率比P1小,说明P2<P1.
②若反应Ⅱ在恒容密闭容器进行,下列能判断反应Ⅱ达到平衡状态的是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的总物质的量不变 d.CH3OH、CO、H2的浓度都不再发生变化
③在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| 2min | 5min | 10min | |
| CO | 0.07 | 0.06 | 0.05 |
| H2 | 0.14 | 0.12 | 0.20 |
| CH3OH | 0.03 | 0.04 | 0.05 |
13.下列有关碱金属元素的性质从上到下递变规律正确的是( )
| A. | 金属性逐渐增强 | |
| B. | 化合价逐渐升高 | |
| C. | 失电子能力逐渐减弱 | |
| D. | 最高价氧化物对应的水化物碱性逐渐减弱 |
10.下列说法不正确的是( )
| A. | 天津港爆炸案中对剧毒的氯化钠(NaCN)喷洒双氧水消毒,是利用了双氧水的氧化性 | |
| B. | 碳酸钙分解、氢氧化钡晶体和氧化铵固体反应,高温下铝与氧化铁反应都是吸热反应 | |
| C. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 | |
| D. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 |