题目内容
20.下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH
(3)呈两性的氢氧化物是Al(OH)3,其与③的最高价氧化物水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O
(4)在③~⑦元素中,原子半径最大的是Na
(5)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
分析 由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为Cl,⑧为Ar,⑨为K,⑩为Br.
(1)同周期自左而右金属性增强,同主族自上而下非金属性减弱,稀有气体化学性质最不活泼;
(2)F元素没有最高价含氧酸,故上述元素中最高价氧化物对应的水化物中酸性最强的是高氯酸,上述元素中K的金属性最强,故氢氧化钾的碱性最强;
(3)氢氧化铝能与酸、碱反应生成相应的盐与水,属于两性氢氧化物;③的最高价氧化物水化物为NaOH,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水;
(4)同周期自左而右原子半径减小;
(5)同一主族从上到下元素非金属性减弱,单质的活泼性逐渐减弱,可以根据单质间的置换反应来证明.
解答 解:由元素在周期表中的位置可知,①为N,②为F,③为Na,④为Mg,⑤为Al,⑥为Si,⑦为Cl,⑧为Ar,⑨为K,⑩为Br.
(1)同周期自左而右金属性增强,同主族自上而下非金属性减弱,稀有气体化学性质最不活泼,故上述元素中最活泼的非金属元素是F,
故答案为:F;
(2)F元素没有最高价含氧酸,故上述元素中最高价氧化物对应的水化物中酸性最强的是HClO4,上述元素中K的金属性最强,故KOH的碱性最强,
故答案为:HClO4;KOH;
(3)Al(OH)3能与酸、碱反应生成相应的盐与水,属于两性氢氧化物;③的最高价氧化物水化物为NaOH,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O;
(4)同周期自左而右原子半径减小,在③~⑦元素中,原子半径最大的是Na,故答案为:Na;
(5)同一主族从上到下元素非金属性减弱,所以氯气的活泼性强于溴单质,可以通过水溶液中的置换反应来证明,反应方程式为2NaBr+Cl2=2NaCl+Br2,
故答案为:Cl2;2NaBr+Cl2=2NaCl+Br2.
点评 本题考查元素周期表与元素周期律综合应用,侧重对元素周期律的考查,注意掌握金属性、非金属强弱比较实验事实.

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 悬浊液 | 金属钠 | |
| X | 中和反应 | 无现象 | 溶解 | 产生氢气 |
| Y | 无现象 | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
| Z | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | 无现象 |
| W | 水解反应 | 无现象 | 无现象 | 无现象 |
(1)写出四种物质的结构简式X:CH3CH2COOH,Y:CH3CHOHCHO,Z:HCOOCH2CH3,W:CH3COOCH3.
(2)①Y与新制Cu(OH)2悬浊液反应的化学方程式
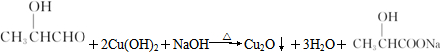 .
.②Z与NaOH溶液反应的化学方程式HCOOCH2CH3+NaOH$\stackrel{△}{→}$HCOONa+CH3CH2OH.
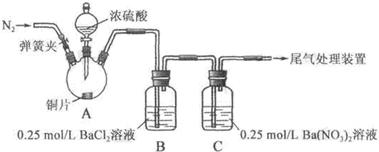
实验操作和现象:
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(2)C中白色沉淀是BaSO4,该沉淀的生成表明SO2具有还原性.
(3)C中液面上方生成浅棕色气体的化学方程式是2NO+O2═2NO2.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是通N2一段时间,排除装置中的空气;乙在A、B间增加洗气瓶D,D中盛放的试剂是饱和NaHSO3溶液.
②进行实验,B中现象:
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
| A. | X的常见氢化物水溶液显弱碱性 | |
| B. | 组成为HZO的物质结构式为H-Z-O | |
| C. | 最高价氧化物对应水化物酸性:Z>X>Y | |
| D. | 简单离子半径:Z>Y>X |
| A. | 0.1mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA | |
| B. | 1mol镁与足量O2或N2反应生成MgO或Mg3N2失去电子分别为2NA和3NA | |
| C. | 含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 某密闭容器中盛有0.2molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6 NA |
| A. | 天津港爆炸案中对剧毒的氯化钠(NaCN)喷洒双氧水消毒,是利用了双氧水的氧化性 | |
| B. | 碳酸钙分解、氢氧化钡晶体和氧化铵固体反应,高温下铝与氧化铁反应都是吸热反应 | |
| C. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 | |
| D. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 |

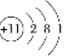 .
.