题目内容
19.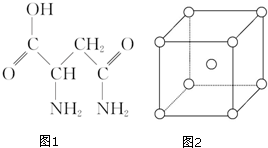 芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.(1)天冬酰胺所含元素中,氮(填元素名称)元素基态原子核外未成对电子数最多,第一电离能最大的是氮.
(2)天冬酰胺中碳原子的杂化轨道类型为sp3和sp2,分子中σ和π键数目之比为8:1.
(3)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表.
| 化学式 | 键长/nm | 键角 |
| H2O | 0.99 | 104.5° |
| H2S | 1.34 | 92.3° |
| H2Se | 1.47 | 91.0° |
(4)写出铬的基态电子排布式:1s22s22p63s23p63d54s1或[Ar]3d54s1.
(5)金属铬为体心立方晶体,晶胞结构如图2,则该晶胞中含有2个铬原子.若铬的密度为ρg•
cm-3,相对原子质量为M,NA表示阿伏加德罗常数的值,则铬原子的半径为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{{N}_{A}ρ}}$cm.
分析 (1)根据天冬酰胺结构可判断所含元素为C、H、N、O,根据价电子排布式可知未成对电子的多少,元素的非金属性越强,其第一电离能越大,但是由于N元素的2p轨道处于半充满状态,故第一电离能大于O;
(2)分子中亚甲基和次甲基中的碳原子均为sp3杂化,羰基碳为sp2杂化,天冬酰胺中含有16个σ键和2个π键;
(3)从所给晶体的性质来判断晶体类型体,根据元素的原子的种类判断化学键的类型;从键长或电负性角度判断,H2O、H2S、H2Se均为分子晶体,根据分子晶体沸点影响因素比较;
(4)铬的原子序数为24,根据构造原理书写电子排布式;
(5)根据均摊法计算原子个数,根据ρ=$\frac{m}{V}$求得晶胞体积,再得到晶胞边长,因为金属钠原子为等径的刚性球且处于体对角线上的三个球相切,所以钠原子的半径为晶胞体对角线的$\frac{1}{4}$,据此可以确定钠原子的半径.
解答 解:(1)天冬酰胺中含有H、C、N、O四种元素,原子基态核外未成对电子分别为1、2,3、2,因此氮元素基态原子核外未成对电子数最多.H、C、N、O第一电离能最大的是N,
故答案为:氮;氮;
(2)分子中亚甲基和次甲基中的碳原子均为sp3杂化,羰基碳为sp2杂化,天冬酰胺中含有16个σ键和2个π键,因此σ和π键数目之比为8:1,
故答案为:sp3和sp2;8:1;
(3)硫原子的电负性强于Se,形成的共用电子对斥力大,因此H2S中键角大,H2O、H2S、H2Se均为分子晶体,由于水分子间存在氢键,因此其沸点高于H2S和H2Se,H2Se相对分子质量大于H2S,故沸点H2Se高于H2S,酸性由强到弱的顺序为H2Se>H2S>H2O;
故答案为:由于硫的电负性强于Se,形成的共用电子对斥力大,键角大;H2O>H2Se>H2S;H2Se>H2S>H2O;
(4)铬的原子序数为24,根据构造原理其基态电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1,
故答案为:1s22s22p63s23p63d54s1或[Ar]3d54s1;
(5)在铬的晶胞中含有铬原子数为1+8×$\frac{1}{8}$=2,设晶胞边长为x,根据ρ=$\frac{m}{V}$得,ρ=$\frac{M}{\frac{{x}^{3}}{2}×{N}_{A}}$,所以x=$\root{3}{\frac{2M}{{N}_{A}ρ}}$,所以晶胞的休对角线长度为$\sqrt{3}$×$\root{3}{\frac{2M}{{N}_{A}ρ}}$,所以钠原子半径=$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{{N}_{A}ρ}}$,
故答案为:2;$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{2M}{{N}_{A}ρ}}$.
点评 本题考查了核外电子排布,分子的构型、化学键的类型、电离能知识及晶胞的计算,中等难度.注意铬的电子排布式半充满状态较稳定.

| A. | 食用油脂饱和程度越大,熔点越高 | |
| B. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| C. | 纯铁易被腐蚀,可以在纯铁中混入碳元素制成“生铁”,以提高其抗腐蚀能力 | |
| D. | 光纤通信是现代化的通信手段,光导纤维的主要成分是晶体硅 |
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 悬浊液 | 金属钠 | |
| X | 中和反应 | 无现象 | 溶解 | 产生氢气 |
| Y | 无现象 | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
| Z | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | 无现象 |
| W | 水解反应 | 无现象 | 无现象 | 无现象 |
(1)写出四种物质的结构简式X:CH3CH2COOH,Y:CH3CHOHCHO,Z:HCOOCH2CH3,W:CH3COOCH3.
(2)①Y与新制Cu(OH)2悬浊液反应的化学方程式
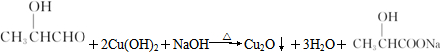 .
.②Z与NaOH溶液反应的化学方程式HCOOCH2CH3+NaOH$\stackrel{△}{→}$HCOONa+CH3CH2OH.
| A. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| B. | “煤改气”“煤改电”等清洁燃料改造工程有利于减少雾霾天气 | |
| C. | 利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染 | |
| D. | 焰火的五彩缤纷是某些金属元素化学性质的展现 |
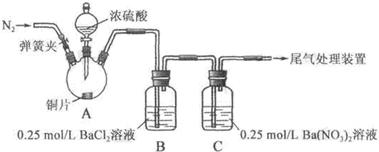
实验操作和现象:
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(2)C中白色沉淀是BaSO4,该沉淀的生成表明SO2具有还原性.
(3)C中液面上方生成浅棕色气体的化学方程式是2NO+O2═2NO2.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是通N2一段时间,排除装置中的空气;乙在A、B间增加洗气瓶D,D中盛放的试剂是饱和NaHSO3溶液.
②进行实验,B中现象:
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
| A. | X的常见氢化物水溶液显弱碱性 | |
| B. | 组成为HZO的物质结构式为H-Z-O | |
| C. | 最高价氧化物对应水化物酸性:Z>X>Y | |
| D. | 简单离子半径:Z>Y>X |
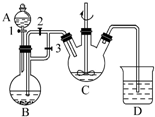 某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:
某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题: 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A原子,C原子的L能层中,都有两个未成对的电子,C、D同主族. E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A原子,C原子的L能层中,都有两个未成对的电子,C、D同主族. E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: ,F原子的电子排布式是1s22s22p63s23p63d104s1;
,F原子的电子排布式是1s22s22p63s23p63d104s1; ;
;