题目内容
12.氯化钠对于地球上的生命非常重要,可用于食品业盐腌和精制食盐.(1)松花蛋于明朝初年问世,其腌制配方有多种,但主要配料为生石灰(Ca0)、纯碱(Na2C03)和食盐(NaCl).将一定比例的配料用水和黏土调制成糊状,敷于蛋上,密封保存,数日后即可食用.
①将松花蛋外的糊状物用足量水溶解,溶解过程中反应的化学方程式分别为CaO+H2O=Ca(OH)2、Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
②某同学设计如表所示的实验方案,探究①中反应后过滤所得滤液中可能含有的物质,请你帮他完善实验方案.
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤液,滴加适量K2CO3溶液 | 若出现白色沉淀 | 滤液中含Ca(OH)2 |
| 若无白色沉淀 | 滤液中无Ca(OH)2 | |
| 另取少量滤液,滴入适量盐酸 | 若出现气泡 | 滤液中含Na2CO3 |
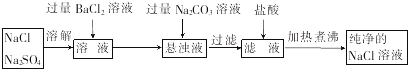
①氯化钡溶液不能(填“能”或“不能”)用硝酸钡溶液代替,理由是会引入新的杂质.
②加入碳酸钠溶液的目的是除去过量的Ba2+,为什么不先过滤而后加入碳酸钠溶液,理由是一次性过滤出硫酸钡和碳酸钡沉淀,避免重复操作.
分析 (1)①CaO与水反应后生成氢氧化钙,再与碳酸钠反应生成碳酸钙;
②Ca(OH)2 易与K2CO3溶液反应生成沉淀,Na2CO3与盐酸反应生成气体,以此检验;
(2)由分离流程可知,溶解后加氯化钡发生BaCl2+Na2SO4═BaSO4↓+2NaCl,再加碳酸钠发生BaCl2+Na2CO3═BaCO3↓+2NaCl,过滤后加盐酸发生2HCl+Na2CO3═2NaCl+H2O+CO2↑,加热煮沸得到纯净的NaCl,以此来解答.
解答 解:(1)①腌制松花蛋的配料有生石灰,加入水发生:CaO+H2O=Ca(OH)2,生成的Ca(OH)2与纯碱发生Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,
故答案为:CaO+H2O=Ca(OH)2;
②由Ca(OH)2 易与K2CO3溶液反应生成沉淀,滴加适量K2CO3溶液,如有白色沉淀,则说明滤液中含有Ca(OH)2,否则无Ca(OH)2;
由Na2CO3与盐酸反应生成气体,取少量滤液,加入过量盐酸,如有气泡生成,则说明含有Na2CO3,如无气泡生成,则说明没有Na2CO3.
若实验①检验出有Ca(OH)2,则肯定没有Na2CO3的存在;
故答案为:
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤液,滴加适量K2CO3溶液 | 若出现白色沉淀 | 滤液中含Ca(OH)2 |
| 若无白色沉淀 | 滤液中无Ca(OH)2 | |
| 另取少量滤液,滴入适量盐酸 | 若出现气泡 | 滤液中含Na2CO3 |
(2)由分离流程可知,溶解后加氯化钡发生BaCl2+Na2SO4═BaSO4↓+2NaCl,再加碳酸钠发生BaCl2+Na2CO3═BaCO3↓+2NaCl,过滤后加盐酸发生2HCl+Na2CO3═2NaCl+H2O+CO2↑,加热煮沸得到纯净的NaCl,
①氯化钡溶液不能用硝酸钡溶液代替,理由是会引入新的杂质(NO3-),故答案为:不能;会引入新的杂质;
②加入碳酸钠溶液的目的是除去过量的Ba2+,不先过滤而后加入碳酸钠溶液,理由是一次性过滤出硫酸钡和碳酸钡沉淀,避免重复操作,
故答案为:除去过量的Ba2+;一次性过滤出硫酸钡和碳酸钡沉淀,避免重复操作.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、混合物分离提纯、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物性质的应用,题目难度不大.

练习册系列答案
相关题目
4.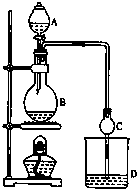 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
已知:
①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
请回答:
(1)浓硫酸的作用:催化剂、吸水剂,请用同位素18O示踪法确定该反应原理,写出能表示18O在反应前后位置变化的化学方程式:CH3COOH+CH3CH218OH CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、和水,应先加入无水氯化钙,分离出乙醇,再加入(此空从下列选项中选择)C,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯.
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:
①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用:催化剂、吸水剂,请用同位素18O示踪法确定该反应原理,写出能表示18O在反应前后位置变化的化学方程式:CH3COOH+CH3CH218OH
 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.(2)球形干燥管C的作用是防止倒吸、冷凝.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、和水,应先加入无水氯化钙,分离出乙醇,再加入(此空从下列选项中选择)C,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯.
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰.
1.已知下表所示数据:
某学生实验室制取乙酸乙酯的主要步骤如下:
①在30mL的大试管A中按体积比2:3:3配制浓硫酸、乙醇和乙酸的混合溶液.
②按图甲连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管5~10min.
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层,洗涤、干燥.

请根据题目要求回答下列问题:
(1)配制该混合液的主要操作步骤为在一个30mL的大试管中注入3mL乙醇,再分别缓缓加入2mL浓硫酸、3mL乙酸(乙醇和浓硫酸的加入顺序不可互换),边加边振荡试管使之混合均匀;
(2)步骤②中需要小火均匀加热,其主要原因是反应物乙醇、乙酸的沸点较低,若用大火加热,反应物随产物蒸出而大量损失,而且温度过高可能发生更多的副反应;
(3)指出步骤③所观察到的现象:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅.
分离出乙酸乙酯层后,一般用饱和食盐水或饱和氯化钙溶液洗涤,可通过洗涤主要除去碳酸钠和乙醇(填名称)杂质;为了干燥乙酸乙酯可选用的干燥剂为B(填选项字母).
A.P2O5 B.无水Na2SO4
C.碱石灰 D.NaOH固体
(4)某化学课外小组设计了如图乙所示的制取乙酸乙酯的装置(图中的部分装置略去),与图甲装置相比,图乙装置的主要优点有①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了冷凝装置,有利于收集产物乙酸乙酯.
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | - | 338.0 | 1.84 |
①在30mL的大试管A中按体积比2:3:3配制浓硫酸、乙醇和乙酸的混合溶液.
②按图甲连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管5~10min.
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层,洗涤、干燥.

请根据题目要求回答下列问题:
(1)配制该混合液的主要操作步骤为在一个30mL的大试管中注入3mL乙醇,再分别缓缓加入2mL浓硫酸、3mL乙酸(乙醇和浓硫酸的加入顺序不可互换),边加边振荡试管使之混合均匀;
(2)步骤②中需要小火均匀加热,其主要原因是反应物乙醇、乙酸的沸点较低,若用大火加热,反应物随产物蒸出而大量损失,而且温度过高可能发生更多的副反应;
(3)指出步骤③所观察到的现象:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅.
分离出乙酸乙酯层后,一般用饱和食盐水或饱和氯化钙溶液洗涤,可通过洗涤主要除去碳酸钠和乙醇(填名称)杂质;为了干燥乙酸乙酯可选用的干燥剂为B(填选项字母).
A.P2O5 B.无水Na2SO4
C.碱石灰 D.NaOH固体
(4)某化学课外小组设计了如图乙所示的制取乙酸乙酯的装置(图中的部分装置略去),与图甲装置相比,图乙装置的主要优点有①增加了温度计,便于控制发生装置中反应液的温度,减少副产物的发生;②增加了分液漏斗,有利于及时补充反应混合液,以提高乙酸乙酯的产量;③增加了冷凝装置,有利于收集产物乙酸乙酯.
2.α-铁纳米粉在现代电子工业上用途广泛,用赤铁矿石(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO等)制备纳米铁颗粒的实验流程如下:

已知:部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
(1)步骤②滤液b中含有的金属阳离子是Cu2+、Al3+,步骤④中碾碎的目的是增大接触面积,提高原料的转化率和反应速率.
(2)将第①步过滤所得的MnO2与KClO3、KOH溶液共热,可得到K2MnO4和KCl,此反应的化学方程式是3MnO2+6KOH+KClO3=3K2MnO4+KCl+3H2O.
(3)步骤③灼烧所需的仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳.
(4)“纳米铁”在空气中受撞击时会燃烧,其反应与铁在纯氧中燃烧相同,写出该反应的化学方程式3Fe+2O2$\frac{\underline{\;撞击\;}}{\;}$Fe3O4.

已知:部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
(2)将第①步过滤所得的MnO2与KClO3、KOH溶液共热,可得到K2MnO4和KCl,此反应的化学方程式是3MnO2+6KOH+KClO3=3K2MnO4+KCl+3H2O.
(3)步骤③灼烧所需的仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳.
(4)“纳米铁”在空气中受撞击时会燃烧,其反应与铁在纯氧中燃烧相同,写出该反应的化学方程式3Fe+2O2$\frac{\underline{\;撞击\;}}{\;}$Fe3O4.
 N2O3(g)+O2(g)、②N2O3(g)
N2O3(g)+O2(g)、②N2O3(g) 为
为 定条件下,对于A2(g)+3B2(g)
定条件下,对于A2(g)+3B2(g) 2AB3(g)反应来说,下列所表示的化学反应速率中最大的
2AB3(g)反应来说,下列所表示的化学反应速率中最大的 是
是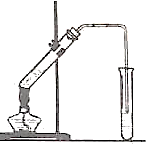 如图,在左试管中先加入2mL95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.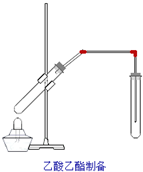 如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验
如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验