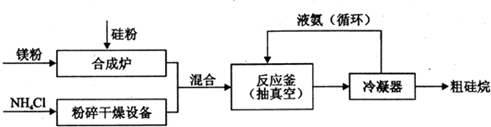
题目内容
在一 定条件下,对于A2(g)+3B2(g)
定条件下,对于A2(g)+3B2(g) 2AB3(g)反应来说,下列所表示的化学反应速率中最大的
2AB3(g)反应来说,下列所表示的化学反应速率中最大的 是
是
A.v(A2)=0.8 mol·L-1·s-1 B.v(A2)=40 mol·L-1·min-1
C.v(AB3)=1.0 mol·L-1·s-1 D.v(B2)=1.2 mol·L-1·s-1
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列说法正确的是( )
| A. | 由KClO3变成KCl必须加入还原剂 | |
| B. | 向醋酸溶液中加入少量氢氧化钠溶液,因发生中和反应,溶液的导电能力降低 | |
| C. | 已知氨水的密度比水小,且浓度越大密度越小.则质量分数分别为5%和15%的氨水等体积混合,得到的溶液的质量分数大于10% | |
| D. | 一定条件下,H2与O2的混合气体对氮气的相对密度为1,则H2与O2的物质的量之比为2:13 |
5.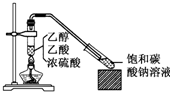 实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊试液1毫升,发现紫色石蕊试液存在于饱和碳酸钠溶液层与乙酸乙酯液层之间(整个过程不振荡试管),下列有关该实验的描述,不正确的是( )
实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊试液1毫升,发现紫色石蕊试液存在于饱和碳酸钠溶液层与乙酸乙酯液层之间(整个过程不振荡试管),下列有关该实验的描述,不正确的是( )
 实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊试液1毫升,发现紫色石蕊试液存在于饱和碳酸钠溶液层与乙酸乙酯液层之间(整个过程不振荡试管),下列有关该实验的描述,不正确的是( )
实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊试液1毫升,发现紫色石蕊试液存在于饱和碳酸钠溶液层与乙酸乙酯液层之间(整个过程不振荡试管),下列有关该实验的描述,不正确的是( )| A. | 制备的乙酸乙酯中混有乙酸和乙醇杂质 | |
| B. | 该实验中浓硫酸的作用是催化和吸水 | |
| C. | 饱和碳酸钠溶液主要作用是降低乙酸乙酯的溶解度及吸收乙醇、中和乙酸 | |
| D. | 石蕊层为三层环,由上而下是蓝、紫、红 |
12.氯化钠对于地球上的生命非常重要,可用于食品业盐腌和精制食盐.
(1)松花蛋于明朝初年问世,其腌制配方有多种,但主要配料为生石灰(Ca0)、纯碱(Na2C03)和食盐(NaCl).将一定比例的配料用水和黏土调制成糊状,敷于蛋上,密封保存,数日后即可食用.
①将松花蛋外的糊状物用足量水溶解,溶解过程中反应的化学方程式分别为CaO+H2O=Ca(OH)2、Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
②某同学设计如表所示的实验方案,探究①中反应后过滤所得滤液中可能含有的物质,请你帮他完善实验方案.
(2)为了将混有少量硫酸钠的氯化钠提纯,并制得纯净的氯化钠溶液,某学生设计如图实验:
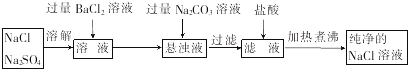
①氯化钡溶液不能(填“能”或“不能”)用硝酸钡溶液代替,理由是会引入新的杂质.
②加入碳酸钠溶液的目的是除去过量的Ba2+,为什么不先过滤而后加入碳酸钠溶液,理由是一次性过滤出硫酸钡和碳酸钡沉淀,避免重复操作.
(1)松花蛋于明朝初年问世,其腌制配方有多种,但主要配料为生石灰(Ca0)、纯碱(Na2C03)和食盐(NaCl).将一定比例的配料用水和黏土调制成糊状,敷于蛋上,密封保存,数日后即可食用.
①将松花蛋外的糊状物用足量水溶解,溶解过程中反应的化学方程式分别为CaO+H2O=Ca(OH)2、Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
②某同学设计如表所示的实验方案,探究①中反应后过滤所得滤液中可能含有的物质,请你帮他完善实验方案.
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤液,滴加适量K2CO3溶液 | 若出现白色沉淀 | 滤液中含Ca(OH)2 |
| 若无白色沉淀 | 滤液中无Ca(OH)2 | |
| 另取少量滤液,滴入适量盐酸 | 若出现气泡 | 滤液中含Na2CO3 |

①氯化钡溶液不能(填“能”或“不能”)用硝酸钡溶液代替,理由是会引入新的杂质.
②加入碳酸钠溶液的目的是除去过量的Ba2+,为什么不先过滤而后加入碳酸钠溶液,理由是一次性过滤出硫酸钡和碳酸钡沉淀,避免重复操作.


 热效应为ΔH2,CuSO4·5H2O 受热分解的化学方程式为:CuSO4·5H2O(s)
热效应为ΔH2,CuSO4·5H2O 受热分解的化学方程式为:CuSO4·5H2O(s)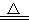 CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是
CuSO4(s)+5H2O(l),热效应为ΔH3。则下列判断正确的是 .ΔH1>ΔH3
.ΔH1>ΔH3 H键的键能分别为436、496和462 kJ·mol-1,则 a 为
H键的键能分别为436、496和462 kJ·mol-1,则 a 为