题目内容
1.在一定条件下,稀醋酸溶液中存在电离平衡:(1)醋酸在水溶液中的电离方程式为CH3COOH?CH3COO-+H+
(2)下列方法,可使0.10mol/L CH3COOH溶液中CH3COOH电离度增大的是abf
(已知:电离度是指弱电解质在溶液里达到电离平衡时,已电离的分子数占原来总分子数的百分数)
a.加水稀释至0.010mol/L b.加热CH3COOH溶液(不考虑醋酸的挥发)
c.加入少量冰醋酸 d.加入少量0.10mol/L 的稀盐酸
e.加入少量醋酸钠固体 f.加入少量0.10mol/L 的NaOH溶液
(3)25℃时,该电离平衡的平衡常数为1.75×10-5.现有:
①0.10mol/L CH3COOH溶液 ②0.0010mol/L CH3COOH溶液
二者c(H+)之比为①:②=10:1.(提示:进行简化计算,平衡时的c(CH3COOH)可用起始浓度代替,水电离出的c(H+)、c(OH-)忽略不计,下同)
分析 (1)醋酸是弱酸,不完全电离;
(2)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
(3)由C(H+)=$\sqrt{Ka×c(C{H}_{3}COOH)}$计算出氢离子浓度,然后计算氢离子浓度之比.
解答 解:(1)醋酸为弱酸,液中部分电离,电离方程式用可逆符号,电离方程式为CH3COOH?H++CH3COO-,
故答案为:CH3COOH?H++CH3COO-;
(2)a.加水稀释促进弱酸的电离,则醋酸的电离程度增大,故正确;
b.醋酸的电离是吸热反应,加热CH3COOH溶液,促进醋酸的电离,则醋酸的电离程度增大,故正确;
c.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故错误;
d.加入少量0.10mol•L-1的稀盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故错误;
e.加入少量醋酸钠固体,醋酸根离子浓度增大,抑制醋酸的电离,则醋酸的电离程度减小,故错误;
f.加入少量0.10mol/L 的NaOH溶液,消耗氢离子,电离平衡正向移动,则醋酸的电离程度增大,故正确;
故答案为:abf;
(3)0.10mol•L-1CH3COOH溶液中C(H+)=$\sqrt{Ka×c(C{H}_{3}COOH)}$mol/L=$\sqrt{1.75×1{0}^{-5}×0.1}$mol/L=$\sqrt{1.75}$×10-3mol/L,0.0010mol•L-1 CH3COOH溶液中C(H+)=$\sqrt{Ka×c(C{H}_{3}COOH)}$mol/L=$\sqrt{1.75×1{0}^{-5}0.001}$=$\sqrt{1.75}$×10-4mol/L,其c(H+)之比为①:②=$\sqrt{1.75}$×10-3mol/L:$\sqrt{1.75}$×10-4mol/L=10:1;
故答案为:10:1.
点评 本题考查了弱电解质的电离、弱电解质电离常数的有关计算、电离方程式的书写等,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握外界条件对电离平衡的移动.

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000mol•L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)步骤③中锥形瓶中的溶液的颜色变化是由红色变为无色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化.
(3)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高(填“偏高”、“偏低”或“无影响”).
(4)步骤②缺少的操作是用蒸馏水后再用标准溶液润洗.
(5)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL.
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.00 |
| A. | v(B2)=1.2mol/(L•s) | B. | v(A2)=0.4 mol/(L•s) | C. | v(C)=0.6 mol/(L•s) | D. | v(B2)=0.8 mol/(L•s) |
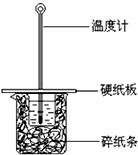 某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法,不正确的是( )
某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法,不正确的是( )| A. | 采用0.55mol/L的NaOH溶液是保证盐酸完全被中和 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是保温隔热,防止热量损失 | |
| D. | 若烧杯上不盖硬纸板,测得的△H将偏小 |
| A. | H2SO4 | B. | KOH | C. | FeCl3 | D. | Ba (NO3)2 |
| A. |  Cu-Zn原电池 | B. |  粗铜的精炼 | C. |  铁片镀锌 | D. |  减缓铁腐蚀 |
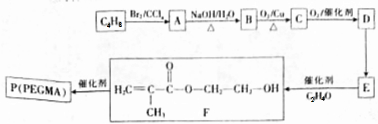
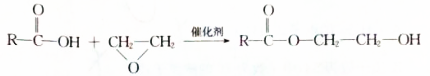
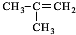 .
.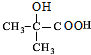 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$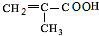 +H2O,该反应的反应类型是消去反应.
+H2O,该反应的反应类型是消去反应.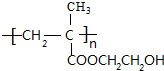 .
.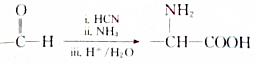 .设计由B合成
.设计由B合成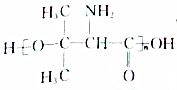 的路线.合成路线流程图请参考如下形式.
的路线.合成路线流程图请参考如下形式.