题目内容
16.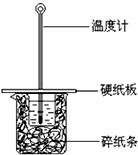 某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法,不正确的是( )
某同学按照课本实验要求,用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法,不正确的是( )| A. | 采用0.55mol/L的NaOH溶液是保证盐酸完全被中和 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是保温隔热,防止热量损失 | |
| D. | 若烧杯上不盖硬纸板,测得的△H将偏小 |
分析 A.为了保证盐酸完全反应,碱会稍微过量一点;
B.根据量热计的结构来确定该装置缺少的仪器;
C.中和热测定实验成败的关键是保温工作,烧杯间填满碎纸条的作用是保温;
D.根据大烧杯上不盖硬纸板,热量容易散失.
解答 解:A.采用0.55mol/L的NaOH溶液,即NaOH过量,是为了保证盐酸完全反应,故A正确;
B.根据量热计的结构可知实验装置缺少环形玻璃搅拌棒,故B正确;
C.中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故C正确;
D.大烧杯上不盖硬纸板,热量容易散失,中和热的数值偏小,但中和热△H会偏大,故D错误;
故选D.
点评 本题考查学生有关中和热测定原理,可以根据所学知识进行回答,注意比较中和热大小时要考虑“-“号.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
6.下列说法中正确的是( )
| A. | 非金属元素呈现的最高正化合价数值上等于该元素原子的最外层电子数 | |
| B. | 非金属元素呈现的最低负化合价,其绝对值等于该元素原子的最外层电子数 | |
| C. | 最外层有2个电子的原子都是金属原子 | |
| D. | 最外层有5个电子的原子都是非金属原子 |
7.有关苯的说法正确的是( )
| A. | 极易溶于水 | B. | 分子为平面正六边形结构 | ||
| C. | 是衡量石油化工发展水平的标志 | D. | 能使紫色的酸性KMnO4溶液褪色 |
11.下列说法正确的是( )
| A. | 吸热反应一定是非自发的化学反应,放热反应不需要加热就能发生反应 | |
| B. | 其它条件不变时,增大压强可以增大活化分子百分数,使化学反应速率加快 | |
| C. | 温度、压强一定时,熵增加的反应都能自发进行 | |
| D. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 |
5.除去苯中少量苯酚的方法是( )
| A. | 加FeCl3溶液、分液 | B. | 加浓溴水、过滤 | ||
| C. | 加液溴反应后蒸馏 | D. | 加NaOH溶液、分液 |
6.常温下,下列溶液中c(H+)最小的是( )
| A. | 0.01mol•L-1的H2SO4溶液 | B. | 0.01mol•L-1的Ba(OH)2溶液 | ||
| C. | c(OH-)=1×10-11mol•L-1的溶液 | D. | c(H+)=1×10-12mol•L-1的溶液 |
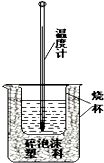 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题: