题目内容
3.对于S+2KNO3+3C$\frac{\underline{\;\;△\;\;}}{\;}$K2S+N2↑+3CO2↑下列说法,不正确的是( )| A. | 该反应中还原剂是C,还原产物有两种 | |
| B. | 若有32g硫参加反应,则被硫氧化的碳单质物质的量为3mol | |
| C. | 若在标准状况下生成8.96L气体,则转移的电子数为1.2NA | |
| D. | 产物中的两种气体在一定条件下都能够和Mg发生反应 |
分析 A、反应S+2KNO3+3C$\frac{\underline{\;\;△\;\;}}{\;}$K2S+N2↑+3CO2↑中N、S元素化合价降低,被还原,则KNO3和S为氧化剂,生成的K2S和N2是还原产物,C元素化合价升高失电子,被氧化,所以C为还原剂,生成的二氧化碳为氧化产物;
B、根据得失电子守恒结合S、C元素化合价变化进行计算;
C、根据方程式计算生成CO2为0.3mol结合C元素化合价变化进行计算;
D、Mg在加热条件下都可以与N2和CO2发生反应.
解答 解:A、反应S+2KNO3+3C$\frac{\underline{\;\;△\;\;}}{\;}$K2S+N2↑+3CO2↑中N、S元素化合价降低,被还原,则KNO3和S为氧化剂,生成的K2S和N2是还原产物,C元素化合价升高失电子,被氧化,所以C为还原剂,故A正确;
B、若有32g硫参加反应,根据得失电子守恒,则被硫氧化的碳单质物质的量为$\frac{32g}{32g/mol}$×2÷4=0.5mol,故B错误;
C、若在标准状况下生成8.96L即$\frac{8.96L}{22.4L/mol}$=0.4mol气体,根据方程式则生成CO2为0.3mol,所以转移的电子数为0.3mol×4=1.2NA,故C正确;
D、Mg在加热条件下都可以与N2和CO2发生反应,故D正确;
故选:B.
点评 本题考查氧化还原反应,为高考高频考点,注意从元素化合价的角度分析物质在反应中的性质,难度不大.

练习册系列答案
相关题目
20.下列有关实验说法正确的是( )
| A. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测结果△H偏小 | |
| B. | 检验溶液中是否有SO42-时,应先将溶液用稀硝酸酸化 | |
| C. | 滴定管在装标准溶液前,必须先用待装标准溶液润洗 | |
| D. | NaHCO3溶液和稀盐酸可以用互滴的方法鉴别 |
14.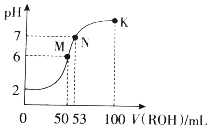 在常温下,向50mL0.01mol•L-1HCl溶液中逐滴加入0.01mol•L-1ROH溶液,如图所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法不正确的是( )
在常温下,向50mL0.01mol•L-1HCl溶液中逐滴加入0.01mol•L-1ROH溶液,如图所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法不正确的是( )
 在常温下,向50mL0.01mol•L-1HCl溶液中逐滴加入0.01mol•L-1ROH溶液,如图所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法不正确的是( )
在常温下,向50mL0.01mol•L-1HCl溶液中逐滴加入0.01mol•L-1ROH溶液,如图所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法不正确的是( )| A. | ROH为一元弱碱 | |
| B. | M点溶液呈酸性的原因是R++H2O?ROH+H+ | |
| C. | M、N、K三点水的电离程度逐渐减小 | |
| D. | K点溶液中离子浓度c(Cl-)>c(R+)>c(OH-)>c(H+) |
11.电对Zn2+/Zn加入氨水后,其电极电势将( )
| A. | 减小 | B. | 增大 | C. | 不变 | D. | 无法确定 |
18.下列各组离子在溶液中按括号内的物质的量之比混合,得到无色、澄清溶液的是( )
| A. | Fe3+、Na+、Cl-、S2-(1:2:3:1) | B. | NH4+、Ba2+、OH-、NO3-(1:1:1:2) | ||
| C. | K+、H+、I-、AlO2-(1:1:1:1) | D. | Na+、Al3+、Cl-、OH-(4:1:4:3) |
13.5.6g铁粉投入到足量的100mL 2mol/L的稀硫酸中,2min时铁粉刚好溶解,下列表示这个反应的速率正确的是( )
| A. | v(H2SO4)=0.5 mol/(L•min) | B. | v(H2SO4)=1 mol/(L•min) | ||
| C. | v(H+)=0.5 mol/(L•min) | D. | v(FeSO4)=0.5 mol/(L•min) |