题目内容
15.常温时,Ksp[Mg(OH)2]=4×10-12,Ksp[Fe(OH)3]=8.0×10-38;通常认为某离子残留在溶液中的浓度小于1×10-5mol•L-1时就认为该离子已经沉淀完全.假定原溶液中c(Mg2+)=1mol•L-1,c(Fe3+)=0.01mol•L-1.(已知lg2=0.3)
(1)使Fe3+开始沉淀时溶液中pH约为2.3.
(2)当Fe3+沉淀完全时溶液中c(OH-)约为2.0×10-11mol/L;此时Mg2+A
A.尚未开始沉淀 B.已经开始沉淀 C.已经沉淀完全
(3)结论:在含有少量Fe3+的Mg2+ 溶液中,A(填A:可以;B:不可以)用调节pH的方法来除杂.
分析 (1)Fe3+开始沉淀时,满足c(Fe3+)•c(OH-)3>Ksp[Fe(OH)3],根据氢氧化铁的溶度积计算出氢氧根离子浓度,然后结合水的离子积计算出氢离子浓度,最后根据pH=-lgc(H+)计算溶液的pH;
(2)铁离子完全沉淀时,其浓度小于1×10-5mol•L-1,结合氢氧化铁的溶度积计算出此时氢氧根离子浓度;根据镁离子浓度及氢氧化镁的溶度积计算出镁离子开始沉淀需要氢氧根离子浓度,然后根据计算结果进行判断;
(3)根据(2)的计算结果判断.
解答 解:(1)Fe3+开始沉淀时,必须满足c(Fe3+)•c(OH-)3>Ksp[Fe(OH)3]=8.0×10-38,此时c(OH-)>$\root{3}{\frac{8.0×1{0}^{-38}}{0.01}}$mol/L=2.0×10-12mol/L,
所以使Fe3+开始沉淀时溶液中氢离子浓度至少为:c(H+)=$\frac{1{0}^{-14}}{2.0×1{0}^{-12}}$mol/L=5×10-3mol/L,溶液的pH=-lg5×10-3=3-lg5=3-(1-lg2)=2.3,
故答案为:2.3;
(2)当Fe3+沉淀完全时,c(Fe3+)<1×10-5mol•L-1,c(Fe3+)•c(OH-)3>Ksp[Fe(OH)3]=8.0×10-38,溶液中c(OH-)>$\root{3}{\frac{8.0×1{0}^{-38}}{1×1{0}^{-5}}}$mol/L=2.0×10-11mol/L;
c(Mg2+)=1mol•L-1,Mg2+开始沉淀时,c(OH-)=$\sqrt{\frac{4×1{0}^{-12}}{1}}$mol/L=2.0×10-6mol/L,则铁离子沉淀完全时c(OH-)>2.0×10-11mol/L,此时
此时Mg2+尚未开始沉淀,故A正确,
故答案为:2.0×10-11;A;
(3)根据(2)可知,Mg2+开始沉淀时,c(OH-)至少为2.0×10-6mol/L,而此时Fe3+已经沉淀完全,所以在含有少量Fe3+的Mg2+ 溶液中,可以用调节pH的方法来除杂,故A正确,
故答案为:A.
点评 本题考查了难溶物溶解平衡及计算,题目难度中等,明确溶度积的概念及表达式即可解答,注意掌握难溶物溶解平衡及沉淀转化的本质,试题培养了学生的分析能力及化学计算能力.

| A. | 该反应中还原剂是C,还原产物有两种 | |
| B. | 若有32g硫参加反应,则被硫氧化的碳单质物质的量为3mol | |
| C. | 若在标准状况下生成8.96L气体,则转移的电子数为1.2NA | |
| D. | 产物中的两种气体在一定条件下都能够和Mg发生反应 |

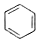 +
+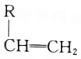 $\stackrel{H_{2}SO_{4}}{→}$
$\stackrel{H_{2}SO_{4}}{→}$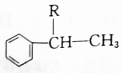 ;
;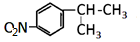 ;A转化为B的反应类型是加成反应.
;A转化为B的反应类型是加成反应. +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$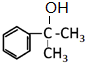 +NaBr.
+NaBr.