题目内容
14.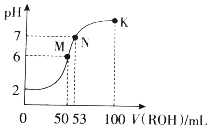 在常温下,向50mL0.01mol•L-1HCl溶液中逐滴加入0.01mol•L-1ROH溶液,如图所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法不正确的是( )
在常温下,向50mL0.01mol•L-1HCl溶液中逐滴加入0.01mol•L-1ROH溶液,如图所示的曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计).下列说法不正确的是( )| A. | ROH为一元弱碱 | |
| B. | M点溶液呈酸性的原因是R++H2O?ROH+H+ | |
| C. | M、N、K三点水的电离程度逐渐减小 | |
| D. | K点溶液中离子浓度c(Cl-)>c(R+)>c(OH-)>c(H+) |
分析 A.50mLROH与盐酸恰好等体积等浓度完全反应,溶液pH=6;
B.M点溶液呈酸性,与弱碱离子水解有关;
C.M点促进水的电离,N、K碱过量,均抑制水的电离;
D.K点显碱性,溶液遵循电荷守恒.
解答 解:A.50mLROH与盐酸恰好等体积等浓度完全反应,溶液pH=6,则生成强酸弱碱盐,ROH为一元弱碱,故A正确;
B.M点溶液呈酸性,与弱碱离子水解有关,发生R++H2O?ROH+H+,故B正确;
C.M点促进水的电离,N、K碱过量,均抑制水的电离,则M、N、K三点水的电离程度逐渐减小,故C正确;
D.K点显碱性,溶液遵循电荷守恒,则K点溶液中离子浓度c(R+)>c(Cl-)>c(OH-)>c(H+),故D错误;
故选D.
点评 本题考查酸碱混合及图象分析,为高频考点,把握酸碱混合后溶液溶质的判断及盐类水解、离子浓度比较为解答本题的关键,侧重分析与应用的考查,注意pH=6时溶质的判断,题目难度不大.

练习册系列答案
相关题目
3.对于S+2KNO3+3C$\frac{\underline{\;\;△\;\;}}{\;}$K2S+N2↑+3CO2↑下列说法,不正确的是( )
| A. | 该反应中还原剂是C,还原产物有两种 | |
| B. | 若有32g硫参加反应,则被硫氧化的碳单质物质的量为3mol | |
| C. | 若在标准状况下生成8.96L气体,则转移的电子数为1.2NA | |
| D. | 产物中的两种气体在一定条件下都能够和Mg发生反应 |