题目内容
11.下列物质的水溶液呈碱性的是( )| A. | K2SO4 | B. | NH4Cl | C. | CH3COONa | D. | H2SO3 |
分析 强酸强碱盐中阴阳离子都不水解,则其水溶液呈中性;强酸弱碱盐,阳离子水解导致溶液呈酸性;强碱弱酸盐,弱酸根离子水解导致溶液呈碱性,酸电离出氢离子导致溶液呈酸性,据此分析解答.
解答 解:A.硫酸钾是强酸强碱盐,钾离子和硫酸根离子都不水解,则其水溶液呈中性,故A错误;
B.氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,故B错误;
C.醋酸钠是强碱弱酸盐,醋酸根离子水解导致水溶液呈碱性,故C正确;
D.亚硫酸是酸,电离出氢离子导致水溶液呈酸性,故D错误;
故选C.
点评 本题以溶液酸碱性判断为载体考查盐类水解,为高频考点,明确盐类特点“有弱才水解、无弱不水解、谁强谁显性、谁弱谁水解、强强显中性”是解本题关键,知道常见盐溶液酸碱性,题目难度不大.

练习册系列答案
相关题目
1.氯元素的相对原子质量为35.5,氯只有35Cl和37Cl两种稳定同位素,则相对分子质量为70,72,74的氯气分子数之比可能是( )
| A. | 5:3:2 | B. | 5:2:3 | C. | 5:1:2 | D. | 9:6:1 |
19.在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
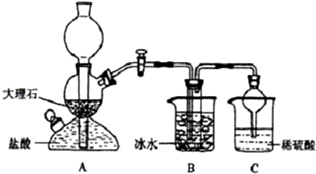
(1)A装置中所发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O.C装置中稀硫酸的作用为:吸收从B装置中的试管内逸出的氨气,减少对环境的污染.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
参照表中数据,请分析B装置中使用冰水是因为温度越低碳酸氢钠溶解度越小,便于析出.
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在AB装置之间(填写字母)连接一个盛有饱和碳酸氢钠溶液 的洗气装置,其作用是除去二氧化碳气体中的氯化氢气体.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为60%.

(1)A装置中所发生反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O.C装置中稀硫酸的作用为:吸收从B装置中的试管内逸出的氨气,减少对环境的污染.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在AB装置之间(填写字母)连接一个盛有饱和碳酸氢钠溶液 的洗气装置,其作用是除去二氧化碳气体中的氯化氢气体.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为60%.
1.北京市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式
1 KIO3+5 KI+3 H2SO4═3 K2SO4+3 I2+3 H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是溶液由蓝色恰好变为无色.
②b中反应所产生的I2的物质的量是1.0×10-5 mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{4.2×1{0}^{2}}{w}$mg/kg.
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
1 KIO3+5 KI+3 H2SO4═3 K2SO4+3 I2+3 H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是溶液由蓝色恰好变为无色.
②b中反应所产生的I2的物质的量是1.0×10-5 mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{4.2×1{0}^{2}}{w}$mg/kg.
18.两电极用导线连接插入电解质溶液中(不考虑溶液中溶解的氧气的影响),你认为不能构成原电池的是( )
| 选项 | A | B | C | D |
| 电极材料 | Zn | Fe | Cu | Al |
| 电极材料 | Cu | Zn | Ag | C |
| 电解质溶液 | CuCl2溶液 | H2SO4溶液 | CuSO4溶液 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
19.下列结论不正确的是( )
| A. | 微粒半径:K+>Al3+>S2->Cl- | B. | 离子的还原性:Cl-<Br-<I- | ||
| C. | 酸性:H2SO4>H3PO4>H2CO3 | D. | 金属性:K>Ca>Mg>Be |
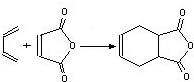
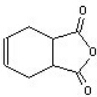 互为同分异构体,一定条件下能与氯化铁溶液发生显色反应,且与NaHCO3溶液反应放出CO2,则该有机物有13种.
互为同分异构体,一定条件下能与氯化铁溶液发生显色反应,且与NaHCO3溶液反应放出CO2,则该有机物有13种. ,请用合成反应的流程图,表示出最合理的合成方案(注明反应条件):
,请用合成反应的流程图,表示出最合理的合成方案(注明反应条件):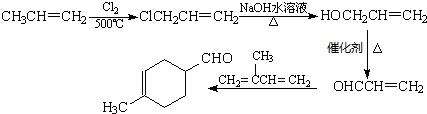 .
.