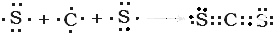题目内容
1.北京市场销售的某种食用精制盐包装袋上有如下说明:| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
1 KIO3+5 KI+3 H2SO4═3 K2SO4+3 I2+3 H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是溶液由蓝色恰好变为无色.
②b中反应所产生的I2的物质的量是1.0×10-5 mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{4.2×1{0}^{2}}{w}$mg/kg.
分析 (1)I元素的化合价由+5价降低为0,KI中I元素的化合价由-1价升高为0,结合电子、原子守恒配平;
(2)Na2SO3稀溶液与I2反应,为氧化还原反应,S元素的化合价升高,I元素的化合价降低;
(3)①淀粉遇碘变蓝,可判断滴定终点;
②Na2S2O3的物质的量是2.0×10-3mol/L×0.01L=2.0×10-5mol,结合I2+2S2O32-═2I-+S4O62-计算I2的物质的量;
③存在KIO3~3I2~6Na2S2O3,以此计算含碘量.
解答 解:(1)碘酸钾中碘元素的化合价由+5价降低到0价,得到5个电子.碘化钾中碘元素的化合价从-1价升高到0价,失去1个电子,所以根据电子的得失守恒以及原子守恒可知,配平后的化学反应为KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,
故答案为:1;5;3;3;3;3;
(2)单质碘被还原,说明作氧化剂,亚硫酸钠作还原剂,所以反应的方程式是I2+SO32-+H2O=2I-+SO42-+2H+,
故答案为:I2+SO32-+H2O=2I-+SO42-+2H+;
(3)①由于碘遇淀粉显蓝色,所以判断c中反应恰好完全时依据的现象是溶液由蓝色恰好变为无色,故答案为:溶液由蓝色恰好变为无色;
②Na2S2O3的物质的量是2.0×10-3mol/L×0.01L=2.0×10-5mol,根据I2+2S2O32-═2I-+S4O62-可知,b中反应所产生的I2的物质的量是2.0×10-5mol×$\frac{1}{2}$=1.0×10-5mol,故答案为:1.0×10-5;
③根据(1)中的反应式可知,KIO3~3I2~6Na2S2O3,所以碘酸钾的物质的量是2.0×10-5mol×$\frac{1}{6}$,因此所测精制盐的碘含量是
$\frac{2.0×1{0}^{-5}×\frac{1}{6}mol×127g/mol×1000mg}{w×1{0}^{-3}kg}$=$\frac{4.2×1{0}^{2}}{w}$mg/kg,故答案为:$\frac{4.2×1{0}^{2}}{w}$.
点评 本题考查物质含量及氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,把握原子、电子守恒及反应中的物质的量关系为解答该题的关键,题目难度不大.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案①反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+
②有胶状物质生成
③有气体产生
④溶液颜色发生变化
⑤共发生了2个氧化还原反应.
| A. | 仅①②③④ | B. | 仅②③④ | C. | 仅①③⑤ | D. | 仅②④⑤ |
| A. | K2SO4 | B. | NH4Cl | C. | CH3COONa | D. | H2SO3 |
| A. | 25℃时,pH=7的NH4Cl与NH3•H2O混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) | |
| B. | 25℃时,向10mL pH=12的NaOH溶液中滴加等体积pH=2的CH3COOH溶液;c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 0.1mol•L-1的CH3COONa溶液与0.1mol•L-1的CaCl2溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 浓度均为0.1mol•L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为③>②>① |
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A. | ①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小 | |
| B. | 分别加水稀释10倍,四种溶液的pH ①>②>④>③ | |
| C. | VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va:Vb=9:11 | |
| D. | ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| A | B |
| ①能使溴的四氯化碳溶液褪色 ②分子比例模型为  ③能与水在一定条件下反应 | ①由C、H两种元素组成 ②分子球棍模型为 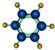 |
(1)A与溴的四氯化碳溶液反应的生成物的名称为1,2-二溴乙烷;写出在一定条件下,A发生聚合反应生成高分子化学反应方程式
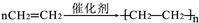 ;
;(2)B具有的性质②③⑦(填序号);
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤能使酸性KMnO4溶液和溴水褪色 ⑥任何条件下均不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色
(3)A的同系物碳原子n=4(填数字)开始出现同分异构体,请写出符合前面要求的A的同系物及其同分异构体的结构简式CH2=CHCH2CH3、CH3CH=CHCH3、CH2=CH(CH3)2.
| A. | 第ⅠA族 | B. | 第ⅣA族 | C. | 第ⅠA族或第ⅠB族 | D. | 第ⅢA族或第ⅢB族 |

 、用电子式表示CJ2的形成过程:
、用电子式表示CJ2的形成过程: