题目内容
19.下列结论不正确的是( )| A. | 微粒半径:K+>Al3+>S2->Cl- | B. | 离子的还原性:Cl-<Br-<I- | ||
| C. | 酸性:H2SO4>H3PO4>H2CO3 | D. | 金属性:K>Ca>Mg>Be |
分析 A.电子层越多,离子半径越大;具有相同电子排布的离子,原子序数大的离子半径小;
B.非金属性越强,对应阴离子的还原性越弱;
C.非金属性越强,对应最高价含氧酸的酸性越强;
D.结合金属活泼性顺序及同主族从上到下金属性增强分析.
解答 解:A.电子层越多,离子半径越大;具有相同电子排布的离子,原子序数大的离子半径小,则微粒半径:S2->Cl->K+>Al3+,故A错误;
B.非金属性越强,对应阴离子的还原性越弱,则离子的还原性:Cl-<Br-<I-,故B正确;
C.非金属性越强,对应最高价含氧酸的酸性越强,则酸性:H2SO4>H3PO4>H2CO3,故C正确;
D.由金属活泼性顺序及同主族从上到下金属性增强可知,金属性:K>Ca>Mg>Be,故D正确;
故选A.
点评 本题考查周期表与周期律的应用,为高频考点,把握元素的位置、元素的性质、元素周期律为解答该题的关键,侧重于学生的分析能力和应用能力的考查,题目难度不大.

练习册系列答案
相关题目
11.下列物质的水溶液呈碱性的是( )
| A. | K2SO4 | B. | NH4Cl | C. | CH3COONa | D. | H2SO3 |
10.下表是关于有机物A、B的信息:
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称为1,2-二溴乙烷;写出在一定条件下,A发生聚合反应生成高分子化学反应方程式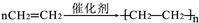 ;
;
(2)B具有的性质②③⑦(填序号);
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤能使酸性KMnO4溶液和溴水褪色 ⑥任何条件下均不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色
(3)A的同系物碳原子n=4(填数字)开始出现同分异构体,请写出符合前面要求的A的同系物及其同分异构体的结构简式CH2=CHCH2CH3、CH3CH=CHCH3、CH2=CH(CH3)2.
| A | B |
| ①能使溴的四氯化碳溶液褪色 ②分子比例模型为  ③能与水在一定条件下反应 | ①由C、H两种元素组成 ②分子球棍模型为 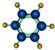 |
(1)A与溴的四氯化碳溶液反应的生成物的名称为1,2-二溴乙烷;写出在一定条件下,A发生聚合反应生成高分子化学反应方程式
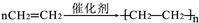 ;
;(2)B具有的性质②③⑦(填序号);
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤能使酸性KMnO4溶液和溴水褪色 ⑥任何条件下均不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色
(3)A的同系物碳原子n=4(填数字)开始出现同分异构体,请写出符合前面要求的A的同系物及其同分异构体的结构简式CH2=CHCH2CH3、CH3CH=CHCH3、CH2=CH(CH3)2.
7.下列推断合理的是( )
| A. | 铜与浓硝酸反应时,硝酸既表现氧化性又表现酸性 | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 | |
| D. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入氯水,氯水褪色后加热也能恢复原色 |
4.下列说法正确的是( )
①1H、2H、3H为三种不同的核素;
②1H、2H、3H互为同位素;
③1H、2H、3H互为同素异形体;
④114号元素位于周期表第七周期VA族;
⑤氢元素质量数为1;
⑥同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置;
⑦互为同位素的原子性质相同.
①1H、2H、3H为三种不同的核素;
②1H、2H、3H互为同位素;
③1H、2H、3H互为同素异形体;
④114号元素位于周期表第七周期VA族;
⑤氢元素质量数为1;
⑥同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置;
⑦互为同位素的原子性质相同.
| A. | ①②⑥⑦ | B. | ①②③⑥ | C. | ①②⑥ | D. | ①②③⑥⑦ |
11.如果n为第ⅡA族中某元素的原子序数,则原子序数为(n+1)的元素可能位于( )
| A. | 第ⅠA族 | B. | 第ⅣA族 | C. | 第ⅠA族或第ⅠB族 | D. | 第ⅢA族或第ⅢB族 |
8.表是元素周期表的一部分,针对表中的①-⑩元素按要求回答下列问题:
(1)在①-⑩元素中,化学性质最不活泼的元素是Ar(填元素符号).
(2)在2周期元素最高价氧化物对应水化物中,酸性最强的化合物的化学式是HNO3.
(3)最高价氧化物属于两性氧化物的元素单质与NaOH溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)④元素与⑧元素形成的化合物高温灼烧时,火焰呈黄色.
(5)⑥的最高价氧化物与烧碱溶液反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O
(6)元素④和③能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 4 | ⑩ |
(2)在2周期元素最高价氧化物对应水化物中,酸性最强的化合物的化学式是HNO3.
(3)最高价氧化物属于两性氧化物的元素单质与NaOH溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)④元素与⑧元素形成的化合物高温灼烧时,火焰呈黄色.
(5)⑥的最高价氧化物与烧碱溶液反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O
(6)元素④和③能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式2Na2O2+2CO2=2Na2CO3+O2.