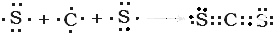题目内容
18.两电极用导线连接插入电解质溶液中(不考虑溶液中溶解的氧气的影响),你认为不能构成原电池的是( )| 选项 | A | B | C | D |
| 电极材料 | Zn | Fe | Cu | Al |
| 电极材料 | Cu | Zn | Ag | C |
| 电解质溶液 | CuCl2溶液 | H2SO4溶液 | CuSO4溶液 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
解答 解:A.锌为活泼金属,可与氯化铜发生氧化还原反应,可形成原电池反应,故A错误;
B.锌比铁活泼,可与硫酸溶液发生氧化还原反应,可形成原电池,故B错误;
C.不能形成自发进行的氧化还原反应,不能形成原电池,故C正确;
D.铝比碳活泼,铝可与氢氧化钠溶液发生氧化还原反应,能形成原电池,故D错误;
故选C.
点评 本题考查了原电池的构成条件,为高频考点,侧重于基础知识的考查,难度不大,注意这几个条件必须同时存在才能形成原电池,缺一不可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列物质的水溶液呈碱性的是( )
| A. | K2SO4 | B. | NH4Cl | C. | CH3COONa | D. | H2SO3 |
13.今有室温下四种溶液,有关叙述不正确的是( )
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A. | ①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小 | |
| B. | 分别加水稀释10倍,四种溶液的pH ①>②>④>③ | |
| C. | VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va:Vb=9:11 | |
| D. | ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
3.X、Y、Z、W四种元素在短周期中相对位置如图,Y、Z质子数之和为21,下列说法正确的是( )
| X | Y | ||
| Z | W |
| A. | 常温下,四种元素单质中,全部是固体 | |
| B. | Z的阳离子与Y的阴离子电子层结构相同 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | W元素原子半径比Z元素原子半径小 |
10.下表是关于有机物A、B的信息:
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称为1,2-二溴乙烷;写出在一定条件下,A发生聚合反应生成高分子化学反应方程式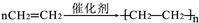 ;
;
(2)B具有的性质②③⑦(填序号);
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤能使酸性KMnO4溶液和溴水褪色 ⑥任何条件下均不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色
(3)A的同系物碳原子n=4(填数字)开始出现同分异构体,请写出符合前面要求的A的同系物及其同分异构体的结构简式CH2=CHCH2CH3、CH3CH=CHCH3、CH2=CH(CH3)2.
| A | B |
| ①能使溴的四氯化碳溶液褪色 ②分子比例模型为  ③能与水在一定条件下反应 | ①由C、H两种元素组成 ②分子球棍模型为 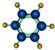 |
(1)A与溴的四氯化碳溶液反应的生成物的名称为1,2-二溴乙烷;写出在一定条件下,A发生聚合反应生成高分子化学反应方程式
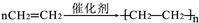 ;
;(2)B具有的性质②③⑦(填序号);
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤能使酸性KMnO4溶液和溴水褪色 ⑥任何条件下均不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色
(3)A的同系物碳原子n=4(填数字)开始出现同分异构体,请写出符合前面要求的A的同系物及其同分异构体的结构简式CH2=CHCH2CH3、CH3CH=CHCH3、CH2=CH(CH3)2.
7.下列推断合理的是( )
| A. | 铜与浓硝酸反应时,硝酸既表现氧化性又表现酸性 | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 | |
| D. | 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入氯水,氯水褪色后加热也能恢复原色 |
8.表是元素周期表的一部分,针对表中的①-⑩元素按要求回答下列问题:
(1)在①-⑩元素中,化学性质最不活泼的元素是Ar(填元素符号).
(2)在2周期元素最高价氧化物对应水化物中,酸性最强的化合物的化学式是HNO3.
(3)最高价氧化物属于两性氧化物的元素单质与NaOH溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)④元素与⑧元素形成的化合物高温灼烧时,火焰呈黄色.
(5)⑥的最高价氧化物与烧碱溶液反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O
(6)元素④和③能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
| 4 | ⑩ |
(2)在2周期元素最高价氧化物对应水化物中,酸性最强的化合物的化学式是HNO3.
(3)最高价氧化物属于两性氧化物的元素单质与NaOH溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)④元素与⑧元素形成的化合物高温灼烧时,火焰呈黄色.
(5)⑥的最高价氧化物与烧碱溶液反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O
(6)元素④和③能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
 、用电子式表示CJ2的形成过程:
、用电子式表示CJ2的形成过程: