题目内容
6.A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系(图中反应条件略去)填写下列空白: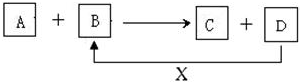
(1)若A为金属铝,B为氧化铁,写出反应A+B→C+D的一种用途焊接钢轨、炼铁等
(2)若A为两性氢氧化物,B为NaOH溶液,写出反应A+B→C+D的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)若A为金属单质,B、C、D都是化合物,A与B发生的反应常用于刻制印刷电路板,该反应的离子方程式Cu+2Fe3+═Cu2++2Fe2+.
(4)若A、B、C为化合物,D、X为单质,A、B、C中肯定含有X元素的是B、C.
分析 (1)A为金属铝,B为氧化铁,考虑铝热反应,反应可以生成氧化铝与铁,铁与氧气反应生成Fe3O4,符合转化;
(2)A为两性氢氧化物,A为Al(OH)3,B为NaOH溶液,反应生成偏铝酸钠和水;
(3)A为金属单质,B、C、D都是化合物,A与B发生的反应常用于制作印刷电路板,则A为Cu,B含有Fe3+,B为FeCl3,反应生成Cu2+与Fe2+,Fe2+与Cl2反应生成FeCl3,符合转化;
(4)A、B、C为化合物,D、X为单质,由转化关系可知,单质D、X化合生成B,B中含有X元素,根据元素守恒可以,C中一定含有X元素.
解答 解:(1)A为金属铝,B为氧化铁,发生铝热反应,生成氧化铝与铁,可以用来焊接钢轨、炼铁等,
故答案为:焊接钢轨、炼铁等;
(2)A为两性氢氧化物,A为Al(OH)3,B为NaOH溶液,反应生成偏铝酸钠和水,反应离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)A为金属单质,B、C、D都是化合物,A与B发生的反应常用于制作印刷电路板,则A为Cu,B含有Fe3+,B为FeCl3,反应生成Cu2+与Fe2+,离子方程式为:Cu+2Fe3+═Cu2++2Fe2+,
故答案为:Cu+2Fe3+═Cu2++2Fe2+;
(4)A、B、C为化合物,D、X为单质,由转化关系可知,单质D、X化合生成B,B中含有X元素,根据元素守恒可以,C中一定含有X元素,故答案为:B、C.
点评 本题是无机框图推断题,考查物质推断与性质,难度较大,掌握元素化合物的性质是解题的关键,需要学生熟练掌握元素化合物知识.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
17.下列叙述正确的是( )
| A. | 尽管NO2能与水反应生成硝酸,但NO2不属于酸性氧化物 | |
| B. | Na2O2粉末加入到FeSO4溶液中,产生白色沉淀,并放出大量气泡 | |
| C. | 氨气和氯化氢气体混合后生成的NH4Cl是离子化合物,因此该反应为离子反应 | |
| D. | 往酸性KMnO4溶液中通入SO2验证SO2的漂白性 |
1.甲乙两同学对保存已久的Na2SO3试剂进行试验探究.
取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解.
(1)测上述溶液的PH值,其PH值>7,原因是(用离子方程式表示)SO32-+H2O HSO3-+OH-
HSO3-+OH-
(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是溶液中的NO3-和H+在一起有强氧化性,会把亚硫酸钡氧化成硫酸钡
(3)假设试剂由Na2SO3和Na2SO4组成,设计试验方案,进行成分检验,他们决定继续探究,请在答题卡上写出实验步骤、预期现象和结论.
限选试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
(4)经实验检验后,确实已变质,现准确测定其中Na2SO3的含量.实验如下:
①配制250ml 约0.2mol•L-1 Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入250mL容量瓶,洗涤,定容,摇匀.
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将 0.05mol•L-1酸性高锰酸钾装入50ml酸式(填酸式或碱式)滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4VmL.
③计算Na2SO3的质量分数=$\frac{2.5V×126}{2000w}$×100%(只列出计算式,不要求算出结果)
取适量Na2SO3样品于洁净烧杯中,加入适量蒸馏水,充分搅拌全部溶解.
(1)测上述溶液的PH值,其PH值>7,原因是(用离子方程式表示)SO32-+H2O
 HSO3-+OH-
HSO3-+OH-(2)取少量上述溶液于试管中,加入硝酸钡溶液生成白色沉淀,再加入盐酸,白色沉淀不溶解,甲认为已变质,乙认为他的结论不科学,理由是溶液中的NO3-和H+在一起有强氧化性,会把亚硫酸钡氧化成硫酸钡
(3)假设试剂由Na2SO3和Na2SO4组成,设计试验方案,进行成分检验,他们决定继续探究,请在答题卡上写出实验步骤、预期现象和结论.
限选试剂及仪器:稀盐酸、稀硝酸、氯化钡溶液,品红溶液,酸性高锰酸溶液,NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置. | |
| 步骤2:取适量步骤1所得溶液于试管中,加入少量的酸性高锰酸钾溶液. | 若溶液褪色,说明其有Na2SO3 若溶液不褪色,说明其中没有Na2SO3 |
| 步骤3:再取适量步骤1所得溶液于另一试管中,先加入足量的稀盐酸,再滴加氯化钡溶液. | 如果有白色沉淀生成,则说明其中有Na2SO4,已经变质. 如果没有白色沉淀生成,则说明其中没有Na2SO4 |
①配制250ml 约0.2mol•L-1 Na2SO3溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水溶解,将溶液转入250mL容量瓶,洗涤,定容,摇匀.
②滴定:准确量取25.00ml Na2SO3所配制溶液于锥形瓶中,将 0.05mol•L-1酸性高锰酸钾装入50ml酸式(填酸式或碱式)滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4VmL.
③计算Na2SO3的质量分数=$\frac{2.5V×126}{2000w}$×100%(只列出计算式,不要求算出结果)
11.下列物质的水溶液呈碱性的是( )
| A. | K2SO4 | B. | NH4Cl | C. | CH3COONa | D. | H2SO3 |
18.下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A. | 25℃时,pH=7的NH4Cl与NH3•H2O混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) | |
| B. | 25℃时,向10mL pH=12的NaOH溶液中滴加等体积pH=2的CH3COOH溶液;c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 0.1mol•L-1的CH3COONa溶液与0.1mol•L-1的CaCl2溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) | |
| D. | 浓度均为0.1mol•L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为③>②>① |
13.今有室温下四种溶液,有关叙述不正确的是( )
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A. | ①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小 | |
| B. | 分别加水稀释10倍,四种溶液的pH ①>②>④>③ | |
| C. | VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va:Vb=9:11 | |
| D. | ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据如图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据如图回答下列问题: (填电子式),B
(填电子式),B (填结构式),E
(填结构式),E (填结构简式).
(填结构简式).