题目内容
14. 某温度下,将等物质的量的A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(s),(正反应为放热反应).当反应进行一段时间后,测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时达到化学平衡状态.则下列说法正确的是( )
某温度下,将等物质的量的A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(s),(正反应为放热反应).当反应进行一段时间后,测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时达到化学平衡状态.则下列说法正确的是( )| A. | 达到化学平衡时A的消耗速率与C的消耗速率相等 | |
| B. | 保持温度不变,再向容器中充入n mol A和$\frac{n}{2}$molB,平衡不移动 | |
| C. | 保持温度不变,再向容器中充入n mol A和n mol B,A、B的转化率均不变 | |
| D. | 如图表示该反应的正反应速率随时间的变化情况,t1时刻可能是减小了A的浓度,增加了C的浓度 |
分析 当反应进行一段时间后,A减少了nmol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,A、B、C、D的化学计量数之比为:n:0.5n:1.5n:n=2:1:3:1,
A.A、C的化学计量数不相等,A的消耗速率与C的消耗速率相等,表明正逆反应速率不相等;
B.加入反应物,平衡向着正向移动;
C.该反应前后气体的体积增大,压强影响化学平衡;
D.t1时正反应速率减小、达到平衡时正逆反应速率比原平衡时大;
解答 解:根据反应物和生成物的物质的量变化可知:A、B、C、D的化学计量数之比为:n:0.5n:1.5n:n=2:1:3:1,
A.达到化学平衡时A的消耗速率与C的消耗速率相等,由于A、C的化学计量数不相等,说明正逆反应速率不相等,反应没有达到平衡状态,故A错误;
B.保持温度不变,再向容器中充入nmolA和0.5n mol B,平衡向着正向移动,达到平衡时各组分的含量、反应物的转化率与原平衡相等,故B错误;
C.保持温度不变,再向容器中充入nmolA和nmolB,由于该反应是体积增大的反应,先等效扩大体积再压缩平衡逆向移动,所以A、B的转化率均减小,故C错误;
D.t1时刻减少了A的浓度,增加了C的浓度,正反应速率减小,逆反应速率增大,达到平衡时正逆反应速率都增大,故D正确;
故选D.
点评 本题考查化学平衡的计算,题目难度中等,涉及化学反应速率与化学平衡图象的综合应用、化学平衡的影响因素,注意明确影响化学反应速率、化学平衡的因素,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.室温时下列溶液中的粒子浓度关系正确的是( )
| A. | 相同物质的量浓度的溶液:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH3•H2O中,c(NH4)由大到小的顺序是:①>③>②>④ | |
| B. | 将等体积的盐酸和氨水混合后pH=7:c(NH4+)>c(Cl-) | |
| C. | 0.1 mol•L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| D. | 向硝酸钠溶液中滴加稀盐酸得到pH=5的混合溶液:c(Na+)=c(NO3-)+c(Cl-) |
2.实验:①0.1mol•L-1AgNO3溶液和0.1mol•L-1NaCl溶液等体积混合得到浊液,过滤.
②分别取少量①的浊液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解
下列分析不正确的是( )
②分别取少量①的浊液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解
下列分析不正确的是( )
| A. | 实验②证明了①的滤液中含有Ag+,由此推断的滤液中也含有Cl- | |
| B. | 由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解 | |
| C. | 实验的溶液中含有[Ag(NH3)2]+微粒 | |
| D. | 实验证明了该温度下Ag2S比Ag2SO4更难溶解 |
9.化工生产中常用FeS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+FeS(s)?CuS(s)+Fe2+(aq),下列有关叙述中正确的是( )
| A. | FeS的Ksp小于CuS的Ksp | |
| B. | 该反应平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ | |
| C. | 溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Fe2+)保持不变 | |
| D. | 达到平衡时c(Fe2+)=c(Cu2+) |
19. 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
请回答下列问题:
(1)保持其他条件不变,若起始时向容器中充入0.60molCO和1.20molH2O,则平衡时n(CO2)=0.4molmol
(2)温度升至800℃,上述反应的平衡常数为0.64,则正反应是放热反应(填“放热”或“吸热”)
(3)700℃时,若向容积为2L的密闭容器中充入CO、H2O、CO2、H2的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应的V正>V逆(填“>”、“<”或“=”)
(4)该反应在t1时刻建立平衡,在t2时刻因改变某个条件导致CO、CO2浓度发生变化的情况如图所示,则t2时刻改变的条件可能是降低温度、增加水蒸汽的量或减少氢气的量(写出两种)
(5)若该容器体积不变、绝热,则下列情况中说明反应建立平衡的是①④
①体系的压强不再发生变化
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④体系的温度不再发生变化.
 700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t2>t1):| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.20 | |
| t2 | 0.80 |
(1)保持其他条件不变,若起始时向容器中充入0.60molCO和1.20molH2O,则平衡时n(CO2)=0.4molmol
(2)温度升至800℃,上述反应的平衡常数为0.64,则正反应是放热反应(填“放热”或“吸热”)
(3)700℃时,若向容积为2L的密闭容器中充入CO、H2O、CO2、H2的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应的V正>V逆(填“>”、“<”或“=”)
(4)该反应在t1时刻建立平衡,在t2时刻因改变某个条件导致CO、CO2浓度发生变化的情况如图所示,则t2时刻改变的条件可能是降低温度、增加水蒸汽的量或减少氢气的量(写出两种)
(5)若该容器体积不变、绝热,则下列情况中说明反应建立平衡的是①④
①体系的压强不再发生变化
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④体系的温度不再发生变化.
6.AlPO4的沉淀溶解平衡曲线如图所示(T2>T1).下列说法正确的是( )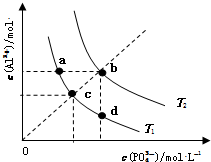

| A. | 图象中四个点的Ksp:a=b>c>d | B. | AlPO4在b点对应的溶解度大于c点 | ||
| C. | AlPO4(s)?Al3+(aq)+PO43-(aq)△H<0 | D. | 升高温度可使d点移动到b点 |
3.某气体由烯烃和烷烃混合而成,经测定其密度为同条件下H2的13倍,则下列说法中正确的是( )
| A. | 混合气体中一定没有甲烷 | B. | 混合气体中一定有乙烯 | ||
| C. | 混合气体可能由甲烷和丙烯组成 | D. | 混合气体一定由乙烯和甲烷组成 |
4.下列离子方程式正确的是( )
| A. | 铁和硝酸银溶液反应 Cu+Ag+=Ag+Cu2+ | |
| B. | 氢氧化铝与硫酸溶液反应 OH-+H+=H2O | |
| C. | 碳酸钙与醋酸溶液反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ | |
| D. | 铁与稀硫酸反应 2Fe+6H+=2Fe3++3H2↑ |