题目内容
2.实验:①0.1mol•L-1AgNO3溶液和0.1mol•L-1NaCl溶液等体积混合得到浊液,过滤.②分别取少量①的浊液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,后者溶液仍澄清③取少量①的沉淀,滴加几滴氨水,沉淀逐渐溶解
下列分析不正确的是( )
| A. | 实验②证明了①的滤液中含有Ag+,由此推断的滤液中也含有Cl- | |
| B. | 由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解 | |
| C. | 实验的溶液中含有[Ag(NH3)2]+微粒 | |
| D. | 实验证明了该温度下Ag2S比Ag2SO4更难溶解 |
分析 ①0.1mol/L AgNO3溶液和0.1mol/L NaCl溶液等体积混合得到浊液,说明生成氯化银沉淀;
②分别取少量①的滤液,分别滴加等浓度等体积的饱和Na2S溶液、饱和Na2SO4溶液,前者出现浑浊,说明生成硫化银,比氯化银更难溶的沉淀,后者溶液仍澄清,说明未生成硫酸银沉淀,此实验说明①过滤后溶液中仍然存在银离子;
③取少量氯化银沉淀,滴加几滴氨水,沉淀逐渐溶解,说明此过程中生成了更难电离的物质:二氨合银离子,以此解答该题.
解答 解:A.由以上分析可知实验②证明了①的滤液中含有Ag+,由此推断①的滤液中也含有Cl-,故A正确;
B.银离子与氨气分子的络合,促进了氯化银的溶解,不能说明银离子与氢氧根也能发生类似络合,故B错误;
C.由以上分析可知加入氨水溶解,则实验③的溶液中含有Ag(NH3)2+微粒,发生络合反应,故C正确;
D.由实验②现象可证明了该温度下Ag2S比Ag2SO4更难溶解,故D正确.
故选B.
点评 本题考查难溶电解质的溶解平衡及沉淀转化的本质,侧重考查学生的分析能力,为高频考点,注意沉淀转化为溶解度更小的物质容易发生,难度不大.

练习册系列答案
相关题目
18.下列有关实验现象的叙述正确的是( )
| A. | 灼烧的铁丝在氯气中燃烧,集气瓶内充满棕黄色烟雾 | |
| B. | 氢气在氯气中燃烧,集气瓶口有白雾 | |
| C. | 向盛水的烧杯中先加入过氧化钠,再滴加酚酞,最终溶液呈红色 | |
| D. | 将Cl2通入紫色石蕊溶液中,溶液变红色 |
3.下列各组离子,在溶液中可以大量共存且为无色的是( )
| A. | Ag+、Cu2+、Cl-、NO3- | B. | Fe2+、NH4+、CO32-、OH- | ||
| C. | Na+、Cl-、K+、OH- | D. | H+、K+、Fe3+、NO3- |
7.下列有关AgCl沉淀的溶解平衡的说法中,正确的是( )
| A. | AgCl沉淀生成和溶解不断进行,但速率相等 | |
| B. | AgCl难溶于水,溶液中没有Ag+和Cl- | |
| C. | 其他条件不变时,加水可使Ksp(AgCl)增大 | |
| D. | 向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变 |
14. 某温度下,将等物质的量的A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(s),(正反应为放热反应).当反应进行一段时间后,测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时达到化学平衡状态.则下列说法正确的是( )
某温度下,将等物质的量的A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(s),(正反应为放热反应).当反应进行一段时间后,测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时达到化学平衡状态.则下列说法正确的是( )
 某温度下,将等物质的量的A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(s),(正反应为放热反应).当反应进行一段时间后,测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时达到化学平衡状态.则下列说法正确的是( )
某温度下,将等物质的量的A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(s),(正反应为放热反应).当反应进行一段时间后,测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时达到化学平衡状态.则下列说法正确的是( )| A. | 达到化学平衡时A的消耗速率与C的消耗速率相等 | |
| B. | 保持温度不变,再向容器中充入n mol A和$\frac{n}{2}$molB,平衡不移动 | |
| C. | 保持温度不变,再向容器中充入n mol A和n mol B,A、B的转化率均不变 | |
| D. | 如图表示该反应的正反应速率随时间的变化情况,t1时刻可能是减小了A的浓度,增加了C的浓度 |
11.常温时,向一定量的硫酸铜溶液中滴加pH=11的氨水,当Cu2+完全沉淀时,消耗氨水的体积为V,下列说法正确的(Ksp[Cu(OH)2]=2.2×10-20)( )
| A. | 滴加过程中,当溶液的pH=7时,溶液中2c(NH4+)=c(SO42-) | |
| B. | 滴加过程中,当溶液中c(Cu2+)=2.2×10-2 mol/L时,溶液的pH=9 | |
| C. | 若滴加pH=11的Na0H溶液,Cu2+完全沉淀时消耗溶液的体积小于V | |
| D. | 若将氨水加水稀释,则稀释过程中,$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$始终保持增大 |
12.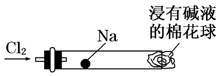 “绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的实验.实验操作:钠与氯气反应的装置可作如右图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述中错误的是( )
“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的实验.实验操作:钠与氯气反应的装置可作如右图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述中错误的是( )
 “绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的实验.实验操作:钠与氯气反应的装置可作如右图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述中错误的是( )
“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的实验.实验操作:钠与氯气反应的装置可作如右图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述中错误的是( )| A. | 反应生成的大量白烟是氯化钠晶体 | |
| B. | 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 | |
| C. | 钠着火燃烧产生苍白色火焰 | |
| D. | 发生的反应为2Na+Cl2═2NaCl |
 由废铜制硝酸铜.用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液.
由废铜制硝酸铜.用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液.