题目内容
3.某气体由烯烃和烷烃混合而成,经测定其密度为同条件下H2的13倍,则下列说法中正确的是( )| A. | 混合气体中一定没有甲烷 | B. | 混合气体中一定有乙烯 | ||
| C. | 混合气体可能由甲烷和丙烯组成 | D. | 混合气体一定由乙烯和甲烷组成 |
分析 某气体由烯烃和烷烃混合而成,经测定其密度为同条件下H2的13倍,相同条件下,气体的密度之比等于其摩尔质量之比,所以该混合物的相对分子质量为13×2=26,则该混合气体中一种物质相对分子质量大于26一种物质相对分子质量小于26,以此解答该题.
解答 解:某气体由烯烃和烷烃混合而成,经测定其密度为同条件下H2的13倍,相同条件下,气体的密度之比等于其摩尔质量之比,所以该混合物的相对分子质量为13×2=26,则该混合气体中一种物质相对分子质量大于26一种物质相对分子质量小于26,
小于26的气体只有甲烷,相对分子质量为16,则一定含有甲烷,另一种气体为烯烃,相对分子质量大于26,可为乙烯、丙烯等,只有C正确.
故选C.
点评 本题考查混合物的计算,为高频考点,侧重于学生的分析、计算能力的考查,利用平均摩尔质量采用讨论方法解答,知道相同条件下气体密度与其摩尔质量的关系,题目难度中等.

练习册系列答案
相关题目
14. 某温度下,将等物质的量的A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(s),(正反应为放热反应).当反应进行一段时间后,测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时达到化学平衡状态.则下列说法正确的是( )
某温度下,将等物质的量的A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(s),(正反应为放热反应).当反应进行一段时间后,测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时达到化学平衡状态.则下列说法正确的是( )
 某温度下,将等物质的量的A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(s),(正反应为放热反应).当反应进行一段时间后,测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时达到化学平衡状态.则下列说法正确的是( )
某温度下,将等物质的量的A、B、C、D四种物质混合于一恒容密闭容器中,发生如下反应:aA(g)+bB(g)?cC(g)+dD(s),(正反应为放热反应).当反应进行一段时间后,测得A减少了n mol,B减少了n/2mol,C增加了3n/2mol,D增加了n mol,此时达到化学平衡状态.则下列说法正确的是( )| A. | 达到化学平衡时A的消耗速率与C的消耗速率相等 | |
| B. | 保持温度不变,再向容器中充入n mol A和$\frac{n}{2}$molB,平衡不移动 | |
| C. | 保持温度不变,再向容器中充入n mol A和n mol B,A、B的转化率均不变 | |
| D. | 如图表示该反应的正反应速率随时间的变化情况,t1时刻可能是减小了A的浓度,增加了C的浓度 |
11.常温时,向一定量的硫酸铜溶液中滴加pH=11的氨水,当Cu2+完全沉淀时,消耗氨水的体积为V,下列说法正确的(Ksp[Cu(OH)2]=2.2×10-20)( )
| A. | 滴加过程中,当溶液的pH=7时,溶液中2c(NH4+)=c(SO42-) | |
| B. | 滴加过程中,当溶液中c(Cu2+)=2.2×10-2 mol/L时,溶液的pH=9 | |
| C. | 若滴加pH=11的Na0H溶液,Cu2+完全沉淀时消耗溶液的体积小于V | |
| D. | 若将氨水加水稀释,则稀释过程中,$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$始终保持增大 |
8.在同温同压下,分子数相同的任意两种气体,它们的( )
| A. | 体积都是22.4L | B. | 密度相同 | C. | 所占体积相同 | D. | 原子数目相同 |
15.实验中需要2mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称量的样品质量分别为( )
| A. | 1000 mL,212 g | B. | 950 mL,201.4 g | C. | 500 mL,286 g | D. | 1000 mL,201.4 g |
12.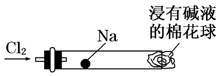 “绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的实验.实验操作:钠与氯气反应的装置可作如右图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述中错误的是( )
“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的实验.实验操作:钠与氯气反应的装置可作如右图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述中错误的是( )
 “绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的实验.实验操作:钠与氯气反应的装置可作如右图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述中错误的是( )
“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的实验.实验操作:钠与氯气反应的装置可作如右图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟.以下叙述中错误的是( )| A. | 反应生成的大量白烟是氯化钠晶体 | |
| B. | 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 | |
| C. | 钠着火燃烧产生苍白色火焰 | |
| D. | 发生的反应为2Na+Cl2═2NaCl |
13.配制250mL0.10mol/L的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是( )
| A. | 转移溶液后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 移液前容量瓶中有少量蒸馏水 | |
| C. | 在容量瓶中进行定容时俯视刻度线 | |
| D. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度 |
 由废铜制硝酸铜.用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液.
由废铜制硝酸铜.用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液.