题目内容
7. 用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管下面,用标准KOH溶液滴定至终点,记下液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)B、D、C、E、A、F.
(2)上述(B)操作的目的是滴定管内壁有一层水膜,如果直接装液会使浓度降低.
(3)判断到达滴定终点的实验现象是锥形瓶内溶液颜色由无色变浅红,半分钟不褪色;
(4)下列操作中可能使所测盐酸的浓度数值偏低的是DE.
A.碱式滴定管未用标准溶液润洗就直接注入标准液
B.滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.读取氢氧化钾溶液体积时,开始仰视读数,滴定结束时俯视读数
E.若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸
(5)若滴定开始和结束时,碱式滴定管中的液面如图,则所用盐酸溶液的体积为25.90 mL.
分析 (1)中和滴定有检漏、洗涤、润洗、装液、滴定等操作;
(2)滴定管在使用之前要润洗,否则相当于把溶液稀释;
(3)用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,滴定终点时,锥形瓶内溶液的颜色变化:锥形瓶中溶液的颜色由无色变浅红且保持半分钟内不褪色,可说明达到滴定终点;
(4)根据公式:c(酸)=$\frac{c(碱)×V(碱)}{V(酸)}$结合实际操作来分析;
(5)滴定管的“0”刻度在最上方,每一个单元格表示的体积是0.10mL,据此回答.
解答 解:(1)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,则正确的顺序为BDCEAF,故答案为:B、D、C、E、A、F;
(2)滴定管内壁有一层水膜,如果直接装液会使浓度降低,所以用标准溶液润洗滴定管2-3次,故答案为:滴定管内壁有一层水膜,如果直接装液会使浓度降低;
(3)用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,滴定终点时,锥形瓶内溶液的颜色变化:锥形瓶中溶液的颜色由无色变浅红且保持半分钟内不褪色,可说明达到滴定终点;
故答案为:锥形瓶内溶液颜色由无色变浅红,半分钟不褪色;
(4)A.碱式滴定管未用标准溶液润洗就直接注入标准液,标准液浓度偏小,则消耗的标准溶液体积偏大,所以测得盐酸的浓度数值偏高,故A错误;
B.滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥,盐酸的物质的量不变,滴定时消耗的KOH的物质的量不变,所以测得盐酸的浓度数值不变,故B错误;
C.碱式滴定管在滴定前有气泡,滴定后气泡消失,则消耗的KOH的物质的量偏大,所以测得盐酸的浓度数值偏高,故C错误;
D.读取氢氧化钠溶液体积时,开始仰视读数,则读数偏大,滴定结束时俯视读数,则读数偏小,所以读数差偏小,即消耗的KOH的体积偏小,则测得盐酸的浓度数值偏小,故D正确;
E.若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,KOH的相对分子质量大于NaOH,造成KOH标准液的浓度偏高,则消耗的KOH的体积偏小,则测得盐酸的浓度数值偏小,故E正确;
故选DE;
(5)根据滴定开始和结束时,碱式滴定管中的液面,则所用盐酸溶液的体积为25.90 mL,故答案为:25.90 mL.
点评 本题考查中和滴定,明确滴定实验中的仪器、数据处理及中和滴定的误差分析是解答本题的关键,注意酸碱中和的实质,题目难度中等.

| A. | 该反应不是氧化还原反应 | B. | 氮气只是氧化产物 | ||
| C. | N2O4是还原剂 | D. | N2O4是氧化剂 |
| A. | 属于置换反应 | B. | 碳发生了还原反应 | ||
| C. | 二氧化硅是氧化剂 | D. | 24g碳充分反应生成28g硅 |
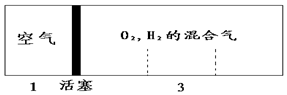 密闭容器中自由移动的活塞两边分别充入空气和H2、O2的混合气体,开始体积比为1:3,若将H2、O2的混合气体点燃引爆,恢复到原来温度(水为液态),活塞右滑停留于容器的正中央,则原来H2、O2的体积比可能为( )
密闭容器中自由移动的活塞两边分别充入空气和H2、O2的混合气体,开始体积比为1:3,若将H2、O2的混合气体点燃引爆,恢复到原来温度(水为液态),活塞右滑停留于容器的正中央,则原来H2、O2的体积比可能为( )| A. | 1:2 | B. | 3:2 | C. | 5:2 | D. | 7:2 |
| A. | HClO 中氯元素化合价比 HClO4 中氯元素化合价低,所以 HClO4 的氧化性强 | |
| B. | 已知①Fe+Cu2+═Fe2++Cu; ②2Fe3++Cu═2Fe2++Cu2+,则氧化性强弱顺序为:Fe3+>Cu2+>Fe2+ | |
| C. | 已知还原性 B->C->D-,反应 2C-+D2═2D-+C2 和 2C-+B2=2B-+C2 都能发生 | |
| D. | 具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应 |
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 2.00 | 0.00 |
| 1 | 0.90 | 1.80 | 0.20 |
| 3 | 0.75 | 1.50 | 0.50 |
| 5 | 0.65 | 1.30 | 0.70 |
| 9 | 0.55 | 1.10 | 0.90 |
| 10 | 0.55 | 1.10 | 0.90 |
| 14 | 0.55 | 1.10 | 0.90 |
 2Z
2Z②该反应在0~5min时间内产物Z的平均反应速率:0.014mol/(L•min)
③该反应达到平衡时反应物X的转化率α等于45%.