题目内容
15.把0.8mol X 气体和0.4mol Y 气体混合于2L 密闭容器中,使它们发生如下反应:2X(g)+Y (g)?n Z (g)+2W (g).2min 末已生成0.2mol W,若测知以Z的浓度变化表示的反应速率为0.05mol•(L•min)-1,计算:(1)前2min内用X的浓度变化表示的平均反应速率;
(2)2min末时Y的浓度.
(3)化学反应方程式中n 值是多少?
分析 把0.8molX气体和0.4molY气体混合于2L容器中,2min末已生成0.2molW,则:
3X(气)+Y(气)═nZ(气)+2W(气)
起始量(mol):0.8 0.4 0 0
变化量(mol):0.3 0.1 0.1n 0.2
2min末(mol):0.5 0.3 0.1n 0.2
(1)根据c=$\frac{n}{V}$计算c(X);
(2)根据三行式确定2min末时Y的浓度;
(3)根据速率计算生成Z的物质的量,进而计算n的值.
解答 解:把0.8molX气体和0.4molY气体混合于2L容器中,2min末已生成0.2molW,则:
3X(气)+Y(气)═nZ(气)+2W(气)
起始量(mol):0.8 0.4 0 0
变化量(mol):0.3 0.1 0.1n 0.2
2min末(mol):0.5 0.3 0.1n 0.2
(1)根据c=$\frac{n}{V}$计算c(X)=$\frac{\frac{0.3mol}{2L}}{2min}$=0.075mol/(L•min),答:前2min内用X的浓度变化表示的平均反应速率为0.075mol/(L•min);
(2)根据三行式确定2min末时Y的浓度为:$\frac{0.3mol}{2L}$=0.15mol/L,答:2min末时Y的浓度为0.15mol/L;
(3)以Z的浓度变化表示的反应速率为0.05mol•(L•min)-1=$\frac{\frac{0.1nmol}{2L}}{2min}$,解得n=2.答:化学反应方程式中n 值是2.
点评 本题考查化学平衡计算、反应速率计算,比较基础,注意对速率定义式的理解与灵活应用.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | HCl和Na2CO3 | B. | 稀H2SO4和NaHCO3 | C. | CaCl2和Na2CO3 | D. | Ba(OH)2和NaHSO4 |
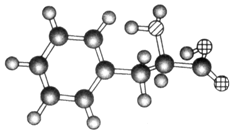
| A. | 该物质的结构简式为 | |
| B. | 该物质可以发生加成反应 | |
| C. | 该物质既可以与强酸反应也可以与强碱反应 | |
| D. | 该物质可以聚合成高分子物质 |