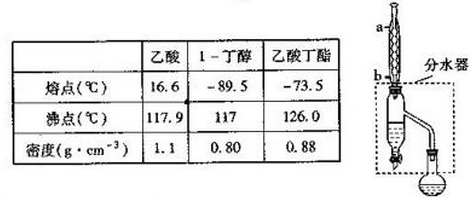
题目内容
11.KI+5KIO3+3H2S=3I2+3K2SO4+3H2O,下列说法正确的是( )| A. | 3 mol H2S可还原4mol的KIO3 | |
| B. | 氧化剂和还原剂物质的量之比为5:4 | |
| C. | I2是还原产物,K2SO4是氧化产物 | |
| D. | 1molKIO3可氧化0.2mol的KI |
分析 KI+5KIO3+3H2S=3I2+3K2SO4+3H2O中,KI中I元素的化合价由-1价升高为0,H2S中S元素的化合价由-2价升高为+6,KIO3中I元素的化合价由+5价降低为0,结合氧化还原反应中基本概念来解答.
解答 解:A.H2S中S元素的化合价由-2价升高为+6,KIO3中I元素的化合价由+5价降低为0,根据得失电子守恒,3molH2S可还原$\frac{3×8}{5}$mol的KIO3,故A错误;
B.该反应中KI中I元素的化合价由-1价升高为0为还原剂,H2S中S元素的化合价由-2价升高为+6为还原剂,KIO3中I元素的化合价由+5价降低为0为氧化剂,所以氧化剂和还原剂物质的量之比为5:4,故B正确;
C.因为I元素的化合价既升高又降低,则生成物I2既是氧化产物又是还原产物,故C错误;
D.该反应中KI中I元素的化合价由-1价升高为0,KIO3中I元素的化合价由+5价降低为0,根据得失电子守恒,1molKIO3可氧化5mol的KI,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及分析能力的考查,题目难度不大.

练习册系列答案
相关题目
16.KMnO4能将草酸(H2C2O4)氧化.在25℃下,某同学欲通过对比实验探究初始pH和草酸浓度对该反应速率的影响.完成实验设计表,表中不要留空格.
(2)某同学欲利用高锰酸钾法测定碳酸钙样品中钙的含量.过程如下:
步骤Ⅰ称取2.50g碳酸钙试样,溶解于稀盐酸,以CaC2O4形式沉淀钙.
沉淀Ⅱ将沉淀过滤洗涤,溶于稀硫酸后定容在250mL容量瓶中.
步骤Ⅲ每次取20.00mL溶液,用0.020mol/L KMnO4标准溶液滴定,三次滴定消耗标准液的平均体积为36.42mL.
①滴定过程中用到的玻璃仪器有酸式滴定管、锥形瓶,滴定终点的现象是加入最后一滴KMnO4溶液,溶液变为浅红色,浅红色30s内不褪去,说明滴定到终点.
②步骤Ⅱ中若将沉淀溶于稀盐酸,会使测定结果偏高(填“偏高”“偏低”或“无影响”).
③试样中钙的质量分数是91.05%.
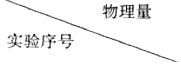 | 初始pH | V(KMnO4)/mL | V(H2C2O4)/mL | V(H2O)/mL |
| ① | 4 | 20 | 10 | |
| ② | 5 | 10 | 5 | |
| ③ | 20 | 10 |
步骤Ⅰ称取2.50g碳酸钙试样,溶解于稀盐酸,以CaC2O4形式沉淀钙.
沉淀Ⅱ将沉淀过滤洗涤,溶于稀硫酸后定容在250mL容量瓶中.
步骤Ⅲ每次取20.00mL溶液,用0.020mol/L KMnO4标准溶液滴定,三次滴定消耗标准液的平均体积为36.42mL.
①滴定过程中用到的玻璃仪器有酸式滴定管、锥形瓶,滴定终点的现象是加入最后一滴KMnO4溶液,溶液变为浅红色,浅红色30s内不褪去,说明滴定到终点.
②步骤Ⅱ中若将沉淀溶于稀盐酸,会使测定结果偏高(填“偏高”“偏低”或“无影响”).
③试样中钙的质量分数是91.05%.
3.电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过下述流程回收Na2Cr2O7等物质.
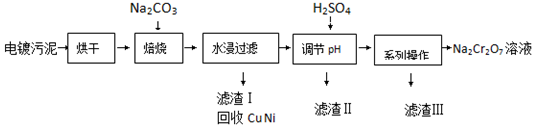
已知:
①Cr(OH)3、ZnO和Al2O3一样均为两性化合物;
②Na2Cr2O7、Na2SO4在不同温度下的溶解度如表:
(1)焙烧过程中生成Na2CrO4的化学方程式为4Cr(OH)3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+6H2O+4CO2;水浸后溶液中除Na2CrO4还存在的溶质有NaAlO2和Na2ZnO2;
(2)加入H2SO4调节pH的目的为除去溶液中NaAlO2、Na2ZnO2杂质,并将CrO42-转化为Cr2O72-;
(3)得到滤渣Ⅲ的“系列操作”的步骤为蒸发浓缩、冷却结晶 过滤;
(4)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g,CrO42-有8/9转化为Cr2O72-,求转化后所得溶液中c(Cr2O72-)=0.2mol•L-1;
(5)向Na2Cr2O7与H2SO4混合液中加入H2O2,再加入乙醚并摇动,乙醚层为蓝色.乙醚中溶有CrO5,则发生反应的化学方程式为Na2Cr2O7+4H2O2+H2SO4═2CrO5+Na2SO4+5H2O.

已知:
①Cr(OH)3、ZnO和Al2O3一样均为两性化合物;
②Na2Cr2O7、Na2SO4在不同温度下的溶解度如表:
| 20℃ | 60℃ | 100℃ | |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
(2)加入H2SO4调节pH的目的为除去溶液中NaAlO2、Na2ZnO2杂质,并将CrO42-转化为Cr2O72-;
(3)得到滤渣Ⅲ的“系列操作”的步骤为蒸发浓缩、冷却结晶 过滤;
(4)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g,CrO42-有8/9转化为Cr2O72-,求转化后所得溶液中c(Cr2O72-)=0.2mol•L-1;
(5)向Na2Cr2O7与H2SO4混合液中加入H2O2,再加入乙醚并摇动,乙醚层为蓝色.乙醚中溶有CrO5,则发生反应的化学方程式为Na2Cr2O7+4H2O2+H2SO4═2CrO5+Na2SO4+5H2O.
2.反应NO+O2+NO2+H2O→HNO3是多组化学计量数的化学方程式,当氧气有$\frac{1}{3}$被NO还原时,此方程式中各物质的化学计量数依次为( )
| A. | 4、9、24、14、28 | B. | 1、1、1、1、2 | C. | 8、9、12、10、20 | D. | 任意比均可 |
3.还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:CrO${\;}_{4}^{2-}$$→_{转换}^{H+}$Cr2O${\;}_{7}^{2-}$$→_{还原}^{Fe_{2}+}$Cr(OH)3.已知转化过程中的反应为2CrO${\;}_{4}^{2-}$(aq)+2H+(aq)?Cr2O${\;}_{7}^{2-}$(aq)+H2O(l).转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有$\frac{10}{11}$转化为Cr2O72-,下列说法不正确的是( )
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4 g | |
| C. | 常温下转化反应的平衡常数K=l04,则转化后所得溶液的pH=1 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+ )降至1×10-5mol/L,应调溶液的pH=5 |