题目内容
3.还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:CrO${\;}_{4}^{2-}$$→_{转换}^{H+}$Cr2O${\;}_{7}^{2-}$$→_{还原}^{Fe_{2}+}$Cr(OH)3.已知转化过程中的反应为2CrO${\;}_{4}^{2-}$(aq)+2H+(aq)?Cr2O${\;}_{7}^{2-}$(aq)+H2O(l).转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有$\frac{10}{11}$转化为Cr2O72-,下列说法不正确的是( )| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4 g | |
| C. | 常温下转化反应的平衡常数K=l04,则转化后所得溶液的pH=1 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+ )降至1×10-5mol/L,应调溶液的pH=5 |
分析 A.溶液颜色保持不变,可知浓度不变;
B.铬元素的含量为28.6g/L,+6价Cr的物质的量为$\frac{28.6g}{52g/mol}$=0.55mol,结合电子守恒计算;
C.常温下转化反应的平衡常数K=l04,则$\frac{\frac{10}{11}×0.55}{(\frac{1}{11}×0.55)^{2}×{c}^{2}({H}^{+})}$=l04,解得c(H+)=0.1mol/L;
D.常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+ )降至1×10-5mol/L,c(OH-)=$\root{3}{\frac{1×1{0}^{-32}}{1×1{0}^{-5}}}$=1×10-9mol/L,则c(H+)=1×10-5mol/L.
解答 解:A.溶液颜色保持不变,可知浓度不变,则上述可逆反应达到平衡状态,故A正确;
B.铬元素的含量为28.6g/L,+6价Cr的物质的量为$\frac{28.6g}{52g/mol}$=0.55mol,由电子守恒可知FeSO4•7H2O的质量为$\frac{0.55×(6-3)}{(3-2)}$mol×278g/mol=458.7g,故B错误;
C.常温下转化反应的平衡常数K=l04,则$\frac{\frac{10}{11}×0.55}{(\frac{1}{11}×0.55)^{2}×{c}^{2}({H}^{+})}$=l04,解得c(H+)=0.1mol/L,则转化后所得溶液的pH=1,故C正确;
D.常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+ )降至1×10-5mol/L,c(OH-)=$\root{3}{\frac{1×1{0}^{-32}}{1×1{0}^{-5}}}$=1×10-9mol/L,则c(H+)=1×10-5mol/L,则应调溶液的pH=5,故D正确;
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握电子守恒计算、溶度积的计算、平衡常数K的计算等为解答的关键,侧重分析与计算能力的考查,注意选项C为解答的难点,题目难度不大.

| A. | 3 mol H2S可还原4mol的KIO3 | |
| B. | 氧化剂和还原剂物质的量之比为5:4 | |
| C. | I2是还原产物,K2SO4是氧化产物 | |
| D. | 1molKIO3可氧化0.2mol的KI |
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
在圆底烧瓶中加入9.6ml(密度约为1.27g.ml-1)苯甲酸和20mL甲醇(密度约0.79g•mL-1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
( 1)加入碎瓷片的作用是防止瀑沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(2)浓硫酸的作用是催化剂、吸水剂混合液体时最后加入浓硫酸的理由:浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,甲醇易挥发.
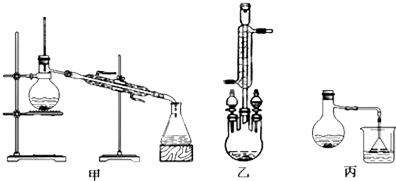
(3)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点最好采用装置乙(填“甲”或“乙”或“丙”).
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中含有少量甲醇、硫酸、苯甲酸和水,现拟用下列流程进行精制,请根据流程图写出操作方法的名称.操作Ⅱ分液;蒸馏.
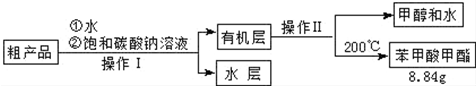
(5)不能用NaOH溶液代替饱和碳酸钠溶液的原因是氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失.
(6)列式计算,苯甲酸甲酯的产率是65%.
有关数据列表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
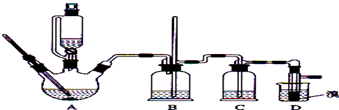
(1)写出实验室制乙烯的反应方程式CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)在此实验中,装置A要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母,下面的选择题相同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在此实验中,装置A中要加些沸石,原因是防止液体暴沸;
(4)在装置C中应加入C,其目的是吸收反应中可能生成的酸性气体:
a.水 b.浓硫酸 c.氢氧化钠溶液 d.CCl4
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(6)若产物中有少量副产物乙醚.应用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发.
| 相对分子质量 | 密度/(g?cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
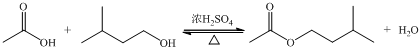
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50min,反应液冷至室温后倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)仪器B的名称是:球形冷凝管
(2)在洗涤、分液操作中,应充分振荡,然后静置,待分层后b(填标号).
a.直接将乙酸异戊酯从分液漏斗上口倒出
b.直接将乙酸异戊酯从分液漏斗下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(3)本实验中加入过量乙酸的目的是:提高醇的转化率.
(4)实验中加入少量无水MgSO4的目的是:干燥.
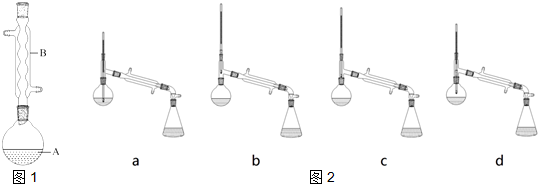
(5)如图2,在蒸馏操作中,仪器选择及安装都正确的是:b (填标号).
(6)本实验的产率是:d(填标号).
a.30% b.40% c.50% d.60%
(7)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏高(填“高”或“低”).
| A. | 若X的反应速率为0.2 mol/(L•s),则Z的反应速率为0.3 mol/(L•s) | |
| B. | 若向容器中充入氦气,压强增大,Y的转化率提高 | |
| C. | 升高温度,正反应速率减小,平衡向逆反应方向移动 | |
| D. | 开始充入容器中的X、Y物质的量之比为2:1 |
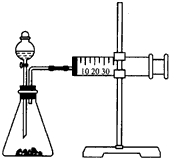 影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.
影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.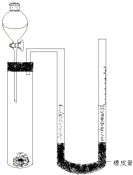 在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下:
在化学研究领域,经常需要对一些物质进行性质的确定.如利用下列装置(夹持仪器已略去)测出一定质量镁与盐酸反应放出的气体体积,对金属镁的相对原子质量进行测定,实验步骤如下: