题目内容
9.请从图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性.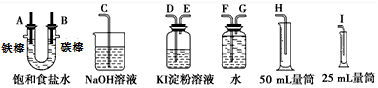
(1)A极发生的电极反应式是2H++2e-=H2↑,B极发生的电极反应式是2Cl--2e-=Cl2↑.
(2)设计上述气体实验装置时,各接口的正确连接顺序为:
A接G、F接H;B接D、E接C.
(3)在实验中,盛有KI淀粉溶液的容器中发生反应的离子方程式为Cl2+2I-=I2+2Cl-.
(4)已知饱和食盐水50mL(假设NaCl足量且忽略溶液体积变化),某时刻测得H2体积为16.8mL(标准状况).此时溶液pH约为12.5.(lg2=0.3,lg3=0.5,lg5=0.7)
(5)已知甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行上述饱和食盐水电解实验.若甲烷通入量为1L(标准状况),且反应完全,则理论上通过电解池的电量为$\frac{1}{22.4}$×8×6.02×1023×1.60×10-19C(已知NA=6.02×1023mol-1,电子电荷为1.60×10-19C,列式表示即可).
分析 (1)A是阴极、B是阳极,用惰性电极电解饱和食盐水时,阴极上氢离子放电生成氢气,阳极上氯离子放电生成氯气;
(2)氯气具有强氧化性,能氧化碘离子生成碘,碘遇淀粉试液变蓝色,所以可以用淀粉KI溶液检验氯气的氧化性,氯气有毒不能排空,应该用碱液吸收尾气;氢气不易溶于水,可以采用排水法收集氢气;
(3)氯气和碘离子发生置换反应生成碘和氯离子;
(4)根据电解饱和食盐水的方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,利用公式C=$\frac{n}{V}$来计算NaOH的物质的量浓度,然后求出氢离子的浓度,最后求出PH;
(5)根据得失电子守恒结合关系式1 mol CH4~8 mol e-计算.
解答 解:(1)A是阴极、B是阳极,用惰性电极电解饱和食盐水时,阴极上氢离子放电生成氢气,阳极上氯离子放电生成氯气,所以阴极、阳极电极反应式分别为2H++2e-=H2↑、2Cl--2e-=Cl2↑,故答案为:2H++2e-=H2↑;2Cl--2e-=Cl2↑;
(2)氯气具有强氧化性,能氧化碘离子生成碘,碘遇淀粉试液变蓝色,所以可以用淀粉KI溶液检验氯气的氧化性,氯气有毒不能排空,应该用碱液吸收尾气;氢气不易溶于水,可以采用排水法收集氢气,所以仪器连接顺序是A接G、F接H;B接D、E接C,
故答案为:G;F;H;D;E;C;
(3)氯气和碘离子发生置换反应生成碘和氯离子,离子方程式为Cl2+2I-=I2+2Cl-,故答案为:Cl2+2I-=I2+2Cl-;
(4)因电解饱和食盐水的方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,当产生的H2的体积为16.8mL即$\frac{0.0168L}{22.4L/mol}$=0.00075mol时,生成氢氧化钠的物质的量为0.0015mol,所以溶液中NaOH的物质的量浓度=$\frac{0.0015}{0.05}$═0.03mol/L,所以氢离子的浓度为$\frac{10{\;}^{-14}}{0.03}$=$\frac{1}{3}$×10-12mol/L,所以pH=12.5,故答案为:12.5;
(5)根据得失电子守恒,可得:1 mol CH4~8 mol e-,则电池甲烷通入量为1 L(标准状况),所以电解池通过的电量为$\frac{1}{22.4}$×8×6.02×1023×1.60×10-19C,故答案为:$\frac{1}{22.4}$×8×6.02×1023×1.60×10-19C.
点评 本题以电解原理为载体考查实验基本操作及物质性质,明确实验目的是解本题关键,根据实验目的及物质性质选取合适的实验装置及连接顺序,难点是实验仪器的连接顺序,题目难度不大.

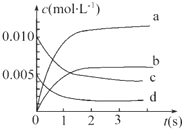 在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2变化曲线的是b.用O2表示0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸.工作时该电池总反应式为:PbO2+Pb+2H2SO4═2PbSO4↓+2H2O,据此判断工作时正极反应为PbO2+4H++SO42-+2e-═PbSO4+2H2O.
(5)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量无污染物质并放出大量热.反应的化学方程式为N2H4+2H2O2=N2+4H2O.
| A. | 在相同温度下,饱和溶液一定比不饱和溶液导电性强 | |
| B. | 氯化钠溶液在电流作用下电离成钠离子和氯离子 | |
| C. | 晶体NaCl不导电,所以它不是电解质,而铜、铁等金属能导电,所以它们是电解质 | |
| D. | 氯化氢溶于水能导电,但液态氯化氢不导电 |
| A. | 8.67---9.26 | B. | 7.00 | C. | 7.35---7.45 | D. | 大于5.70 |
| A. | 溶液的pH将增大 | B. | Na+数和CO32-数的比值将变小 | ||
| C. | 溶液浓度不变,有晶体析出 | D. | 溶液浓度逐渐增大并有晶体析出 |
| A. | 用食醋除去暖水瓶中的薄层水垢 | |
| B. | 一般不用纯碱代替小苏打作食品发酵粉 | |
| C. | 用甲醛溶液浸泡海产品以保鲜 | |
| D. | 用灼烧并闻气味的方法区别纯棉织物和纯毛织物 |
 某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液.检验其中OH-的实验方法省略,检验其他阴离子的过程如图所示.
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液.检验其中OH-的实验方法省略,检验其他阴离子的过程如图所示.