题目内容
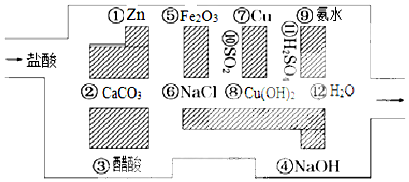
1. 某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液.检验其中OH-的实验方法省略,检验其他阴离子的过程如图所示.
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞溶液.检验其中OH-的实验方法省略,检验其他阴离子的过程如图所示.(1)图中试剂①~⑤溶质的化学式分别是
①Ba(NO3)2,②HCl,③HNO3,④Br2,⑤AgNO3.
(2)图中现象a、b、c表明检验出的离子分别是aSO32-、bSO42-、cCl-.
(3)白色沉淀A加试剂②反应的离子方程式是BaSO3+2H+═Ba2++SO2↑+H2O.
(4)无色溶液C加试剂③的主要目的是中和OH-,防止对Cl-的检验产生干扰.
分析 (1)SO32-、SO42-与Ba(NO3)2溶液反应分别生成亚硫酸钡和硫酸钡白色沉淀,亚硫酸钡与盐酸反应生成二氧化硫气体,二氧化硫气体E能使溴水褪色,硫酸钡不溶解于硝酸中,故试剂①为Ba(NO3)2溶液,试剂②为盐酸或硝酸,试剂④为溴水,无色溶液C呈碱性,加入过量试剂③硝酸调整溶液呈酸性,再加入试剂⑤硝酸银溶液,生成氯化银白色沉淀;
(2)SO32-、SO42-与Ba(NO3)2溶液反应分别生成亚硫酸钡和硫酸钡白色沉淀,亚硫酸钡与盐酸反应生成二氧化硫气体,二氧化硫能使溴水褪色,反应方程式:SO2+Br2+2H2O=H2SO4+2HBr,硫酸钡不溶解,故试剂①为Ba(NO3)2溶液,由此可推测试剂②为某酸,与亚硫酸钡反应放SO2气体,但是后面需要检测SO42-,如果加入硝酸会将SO32-氧化,影响对SO42-的判断,故应为盐酸,试剂④为溴水,所以现象a检验出的阴离子为SO32-,现象b检验出的阴离子为SO42-;无色溶液C呈碱性,加入过量试剂③硝酸调整溶液呈酸性,再加入试剂⑤硝酸银溶液,生成氯化银白色沉淀,故现象c检验出的阴离子为Cl-;
(3)亚硫酸钡可以和强酸反应生成可溶性的钡盐和水以及二氧化硫;
(4)无色溶液A中含有OH-,OH-和硝酸银反应生成氧化银黑色沉淀,干扰对Cl-的检验,所以加入过量稀硝酸,中和OH-,防止对Cl-的检验产生干扰.
解答 解:(1)SO32-、SO42-与Ba(NO3)2溶液反应分别生成亚硫酸钡和硫酸钡白色沉淀,亚硫酸钡与盐酸反应生成二氧化硫气体,二氧化硫气体E能使溴水褪色,硫酸钡不溶解于硝酸中,故试剂①为Ba(NO3)2溶液,试剂②为盐酸或硝酸,试剂④为溴水,无色溶液C呈碱性,加入过量试剂③硝酸调整溶液呈酸性,再加入试剂⑤硝酸银溶液,生成氯化银白色沉淀,
故答案为:Ba(NO3)2;HCl;HNO3;Br2;AgNO3;
(2)SO32-、SO42-与Ba(NO3)2溶液反应分别生成亚硫酸钡和硫酸钡白色沉淀,亚硫酸钡与盐酸反应生成二氧化硫气体,二氧化硫能使溴水褪色,反应方程式:SO2+Br2+2H2O=H2SO4+2HBr,硫酸钡不溶解,故试剂①为Ba(NO3)2溶液,由此可推测试剂②为某酸,与亚硫酸钡反应放SO2气体,但是后面需要检测SO42-,如果加入硝酸会将SO32-氧化,影响对SO42-的判断,故应为盐酸,试剂④为溴水,所以现象a检验出的阴离子为SO32-,现象b检验出的阴离子为SO42-;无色溶液C呈碱性,加入过量试剂③硝酸调整溶液呈酸性,再加入试剂⑤硝酸银溶液,生成氯化银白色沉淀,故现象c检验出的阴离子为Cl-,
故答案为:SO32-;SO42-;Cl-;
(3)亚硫酸钡可以和强酸反应生成可溶性的钡盐和水以及二氧化硫,即BaSO3+2H+═Ba2++SO2↑+H2O,故答案为:BaSO3+2H+=Ba2++SO2↑+H2O;
(4)无色溶液A中含有OH-,OH-和硝酸银反应生成氧化银黑色沉淀,干扰对Cl-的检验,所以加入过量稀硝酸,中和OH-,防止对Cl-的检验产生干扰,
故答案为:中和OH-,防止对Cl-的检验产生干扰.
点评 本题考查无机框图题,为高频考点,涉及常见离子的检验,试题涉及物质的推断、离子的性质及检验方法、化学方程式的书写等知识,根据反应现象推断各物质的成分是解题的关键,综合性较强,题目难度中等.

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案aA(g)+bB(g)?2C(g)
| 起始物质的量浓度(mol/L) | 1.5 | 1 | 0 |
| 2s末物质的量浓度(mol/L) | 0.9 | 0.8 | 0.4 |
②0到2s用物质B来表示的反应速率为0.1mol/(L•s);
③从反应开始到2s末,A的转化率为40%;
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是BE.
A.vB(反应)=vC(生成) B.容器内气体的总压强保持不变
C.容器内气体的密度不变 D.vA:vB:vC=3:2:2
E.容器内气体C的物质的量分数保持不变.
| A. | 分子组成相差一个或几个CH2原子团的有机物是同系物 | |
| B. | 各组成元素质量分数相同的烃是同一种烃 | |
| C. | 分子式相同而结构式不同的有机物一定是同分异构体 | |
| D. | 具有相同通式且相差一个或若干个CH2原子团的有机物一定是同系物 |
| A. | $\frac{ω}{5}$ g•mol-1 | B. | 2ωg | C. | 2ω g•mol-1 | D. | 4ω g•mol-1 |
| A. | 乙烷光照下能与浓盐酸发生取代反应 | |
| B. | 乙烯可以用作生产食品包装材料的原料 | |
| C. | 乙醇室温下在水中的溶解度大于溴乙烷 | |
| D. | 乙酸和甲酸甲酯互为同分异构体 |
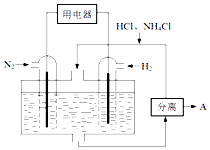 氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.
氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.