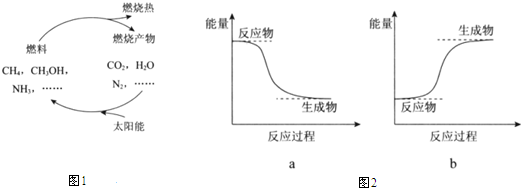
题目内容
20.K2SO4是无氯优质钾肥,MnSO4•H2O在工业、农业等方面有广泛的应用.以硫酸工业的尾气联合制备K2SO4和MnSO4•H2O的工艺流程如图1: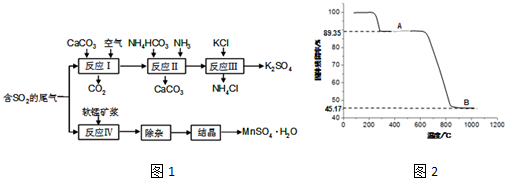
(1)检验K2SO4样品是否含有氯化物杂质的实验操作是取少量样品于试管中配成溶液,滴加过量Ba(NO3)2溶液,取上层清液滴加AgNO3溶液.
(2)已知软锰矿浆主要成分是MnO2,反应IV的化学方程式为MnO2+SO2=MnSO4.
(3)取一定量MnSO4•H2O样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如图2所示(样品在300℃时已完全失去结晶水,900℃以上残留固体为金属氧化物).试通过计算确定曲线中B段所表示物质的化学式(写出计算过程).
分析 硫酸工业的尾气中含有二氧化硫,反应Ⅰ是用碳酸钙、二氧化硫反应生成亚硫酸钙,再被空气中的氧气氧化成硫酸钙,反应Ⅱ为硫酸钙中加入碳酸铵和氨水,生成碳酸钙沉淀和硫酸铵,反应Ⅲ向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、趁热过滤、洗涤、干燥等操作即得K2SO4产品,反应Ⅳ为二氧化锰氧化二氧化硫得硫酸锰,经除杂结晶得硫酸锰晶体,再经加热可得Mn3O4,
(1)检验氯离子,先加硝酸钡排除硫酸根离子干扰,再利用硝酸银检验;
(2)软锰矿浆主要成分是MnO2,与二氧化硫发生氧化还原反应;
(3)设MnSO4•H2O的物质的量为1 mol,
则m(MnSO4•H2O)=1mol×169g•mol-1=169g,
曲线中B段为锰的氧化物,计算Mn、O的原子个数比确定化学式.
解答 解:(1)检验K2SO4样品是否含有氯化物杂质的实验操作是取少量样品于试管中配成溶液,滴加过量Ba(NO3)2溶液,取上层清液滴加AgNO3溶液,观察是否有白色沉淀可确定,
故答案为:取少量样品于试管中配成溶液,滴加过量Ba(NO3)2溶液,取上层清液滴加AgNO3溶液;
(2)软锰矿浆主要成分是MnO2,与二氧化硫发生氧化还原反应,则反应IV的化学方程式为MnO2+SO2=MnSO4,
故答案为:MnO2+SO2=MnSO4;
(3)设MnSO4•H2O的物质的量为1 mol,
则m(MnSO4•H2O)=1mol×169g•mol-1=169g,
曲线中B段为锰的氧化物,其质量为m(氧化物)=169 g×0.4517=76.34g,
其中n(Mn)=1mol,m(Mn)=1mol×55g•mol-1=55g,
则n(O)=$\frac{76.34g-55g}{16g/mol}$,
n(Mn):n(O)=1 mol:$\frac{4}{3}$mol=3:4,
因此B段所表示物质的化学式为Mn3O4,
答:因此B段所表示物质的化学式为Mn3O4.
点评 本题考查物质的制备实验,为高频考点,把握离子检验、氧化还原反应、溶度积计算等为解答的关键,侧重分析与实验、计算能力的考查,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 在有AgCl沉淀的溶液中加入NaC1固体,c(Ag+)减小 | |
| B. | 室温下100mL pH=1.3的Ba(OH)2溶液中OH-的物质的量为0.02 mol | |
| C. | 稀释0.1 mol/L的NH3•H2O溶液,溶液中所有离子浓度均减小 | |
| D. | 溶液中水电离出c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
aA(g)+bB(g)?2C(g)
| 起始物质的量浓度(mol/L) | 1.5 | 1 | 0 |
| 2s末物质的量浓度(mol/L) | 0.9 | 0.8 | 0.4 |
②0到2s用物质B来表示的反应速率为0.1mol/(L•s);
③从反应开始到2s末,A的转化率为40%;
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是BE.
A.vB(反应)=vC(生成) B.容器内气体的总压强保持不变
C.容器内气体的密度不变 D.vA:vB:vC=3:2:2
E.容器内气体C的物质的量分数保持不变.
| A. | 左、下方区域 | B. | 左、上方区域 | C. | 右、上方区域 | D. | 右、下方区域 |
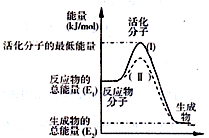 已知反应:3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)+Q
已知反应:3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)+Q(1)写出反应的平衡常数表达式:K=$\frac{{c}^{2}(S{{O}_{4}}^{2-})c({{I}_{3}}^{-})}{{c}^{3}({I}^{-})c({S}_{2}{{O}_{8}}^{2-})}$.
(2)如图表示反应过程中有关物质的能量,则反应过程中的Q>0(填>、<、=);(I)、(II)两曲线中,使用催化剂的是(II)曲线.
(3)反应的速率可以用I3-与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大.如表是在20℃进行实验时所记录的数据
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol•L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-)/mol•L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
| A. | 乙烷光照下能与浓盐酸发生取代反应 | |
| B. | 乙烯可以用作生产食品包装材料的原料 | |
| C. | 乙醇室温下在水中的溶解度大于溴乙烷 | |
| D. | 乙酸和甲酸甲酯互为同分异构体 |